中国临床评价和临床研究
中国临床评价
与一些中文要求略有不同
临床评价和临床研究是中国国家药品监督管理局医疗器械注册申报资料的重要组成部分。临床研究的原则是使医疗器械能够达到预期用途,接受因利益大于产品而产生的风险,并证明符合安全性和有效性要求。
中国的临床评价理念是基于 FDA 的实质等效性,但美国没有临床评价的要求。中国 CER 的监管(2021 年新)除了上市后的细节外,几乎与欧洲的监管一致。主题设备将与同等或类似设备进行比较,这些设备通常具有相同的产品组(中国产品代码)、相似的预期用途和技术特性。
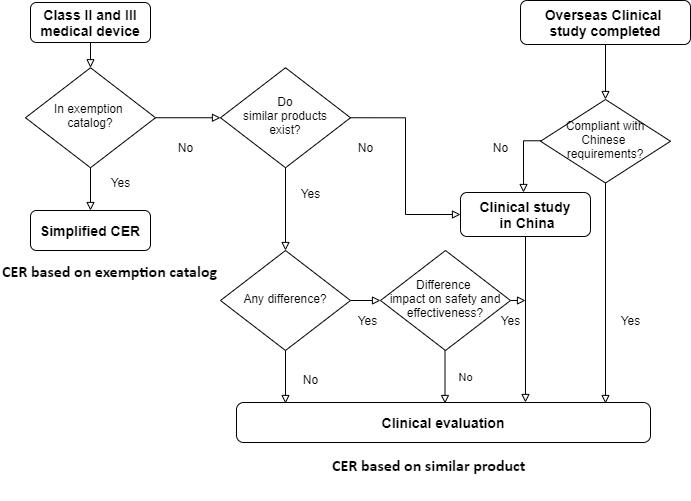
证明中国医疗器械安全性和有效性要求符合性的临床评价有 4 种选择:
- CER 基于豁免目录CER 基于等效或类似设备的CER 与已接受的海外临床研究在中国的临床研究
我们将评估中国II类和III类医疗器械临床评价的要求。
在实际项目中,我们将详细提供临床评估模板。
1. 基于豁免目录的 CER
如果产品在“免于临床试验的医疗器械目录”中,制造商需要将标的器械与目录中的描述以及预期用途、成分、作用机制、制造材料、功能规格、灭菌/消毒等项目进行比较。在中国证明的等效装置的操作方法。这是豁免目录简化临床评价的主要部分。
如果主题医疗器械与类似医疗器械相比,则排除基于豁免目录的 CER:
- 新材料新技术新设计新活性成分新作用机制改变或扩大预期用途性能规格不符合中国标准
《免于临床试验的医疗器械目录》更新
截至目前(2021年10月),《免于临床试验的医疗器械目录》共有1010个产品代码。对于相关的医疗器械,制造商只需要一个简化的 CER。
2. 基于等效或类似设备的 CER
如果产品不在目录中,但在中国存在批准的等效设备(自己的原医疗设备或其他制造商的医疗设备),则需要与等效设备相比进行体面的临床评估。
此类临床评价的范围应符合新指南《医疗器械临床评价2021年第73号/体外诊断临床评价2021年第74号》的要求,与2017/745 MDR的要求相当相似(附件 XIV 和 XV)和欧洲 MDD 的 MEDDEV 2.7/1 修订版 4。
中国 CER 模板
我们介绍中国临床评价的主要章节(2021年新增):
- 产品描述及研发背景临床评价范围临床评价路径用等效设备分析和评价临床数据
一个。通过等效设备的临床数据进行临床评估
- 等效性评估等效器械临床数据总结与评价等效器械临床数据分析
b.通过临床试验数据分析和评估
5.结论
6.临床评价人
定义
临床数据是由使用设备产生的有关安全性或性能的信息。
临床数据=临床前研究 临床文献 临床研究 不良事件 纠正措施等。
等效设备
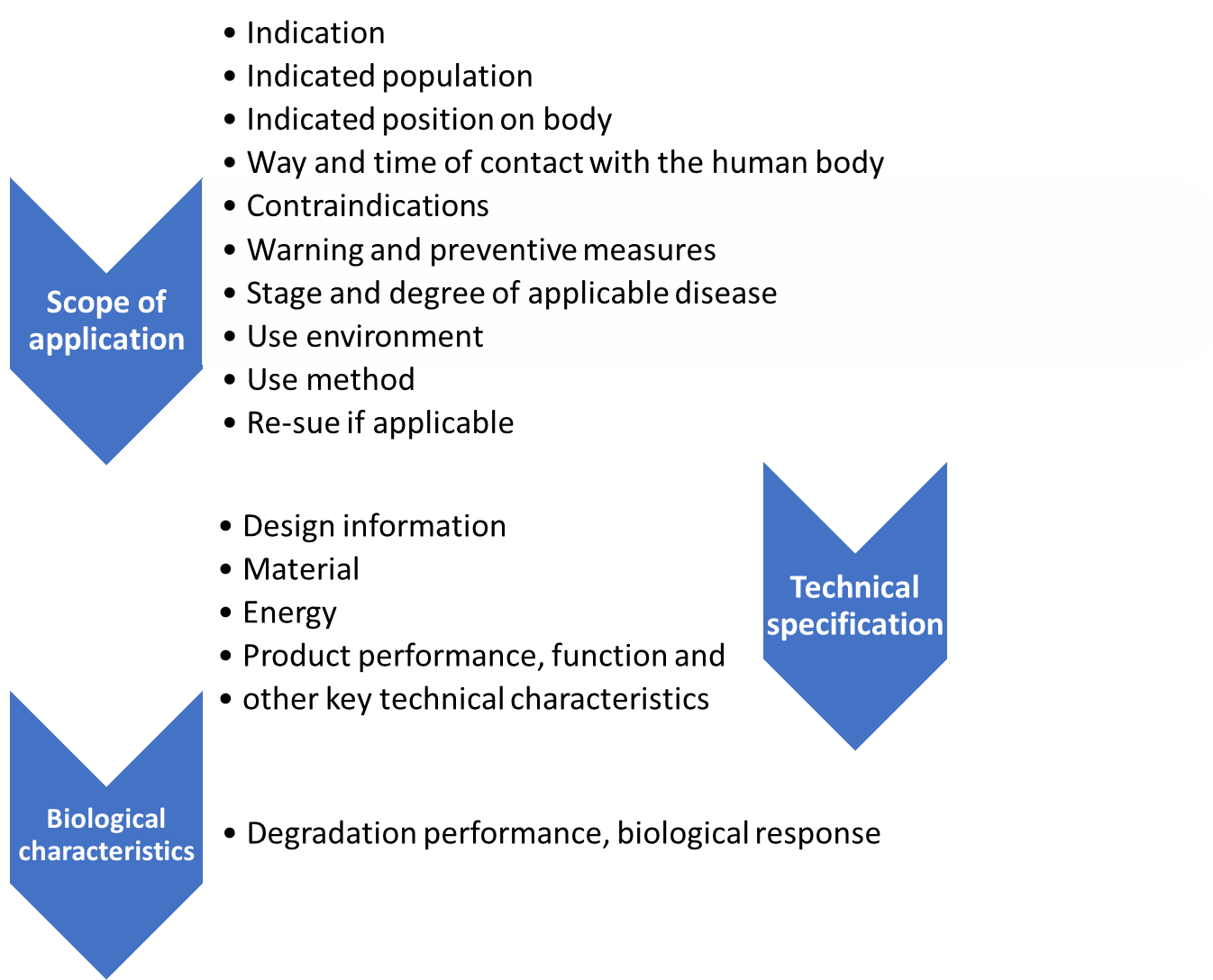
为了确定等效设备,应在主题设备和等效设备之间比较以下项目。
如图 3 所示,应用范围、技术和生物学特性是在中国临床评估中选择等效设备的主要标准。它与临床评估 - 等效性(MDCG 2020-5)几乎相同,其中应用范围称为临床特征。
等效设备≠同类设备
在新指南中引入了类似器械的定义。主题和比较设备之间可能存在差异。差异将在图 3 中按三类进行分析。在这种情况下,支持材料可以是实验室(临床前)测试和临床试验数据。支持材料包括实验室检测的,应以附件形式提交检测计划和检测报告。
3.接受海外临床研究的CER
中国权威机构是否可以接受医学研究的海外临床研究?在中国的情况下,答案肯定是肯定的。我们帮您分析2018年《医疗器械境外临床试验数据准入》指南。前提是符合ISO 14155的良好临床实践的境外临床研究。境外厂商至少要提供临床研究计划、伦理意见和临床研究方案。
接受海外临床研究必须考虑以下因素:
- 临床研究终点 人群偏差(亚裔)研究条件是必要的
制造商可以解释为什么亚洲种族不适用于主题项目,并得出不需要在中国进行补充临床研究的结论。
NMPA在与国际医疗器械法规接轨的同时,尝试接受越来越多的海外临床研究,趋势良好。建议在开始海外临床研究甚至上市后临床随访(PMCF)研究(欧盟)之前检查中国的临床要求。值得在多中心临床研究中考虑中国的临床需求。
4. 中国临床研究
最复杂和成本密集的情况是海外制造商必须在中国进行临床研究。适用于部分III类医疗器械,虽然可以接受境外临床研究,但仍被当局列为高风险产品。该临床研究最有可能针对没有在中国获批的类似产品的创新产品。在中国进行临床研究通常至少需要2个临床研究机构。
中国临床良好实践新指南(2022)
这是中国临床研究的粗略工作流程。输入是临床研究计划。第一个申请是在伦理委员会。随后向权威机构申请临床研究,如果在60个工作日内没有权威机构的反馈,制造商可以在医院进行临床研究。最后,如上所述,研究方案被整合到临床评估中。
在临床研究申请前,下列文件应提交伦理委员会:
- 临床研究计划 研究人员手册 知情同意 受试者招募和晋升程序文件 病例报告表 自检报告和型式试验报告 研究人员的简历、专业知识、能力、培训等证明其资格的文件 临床研究组织的设施和条件 试验医学发展的声明器械符合适用的医疗器械质量管理体系的相关要求
随后将进行临床研究申请,并附上以下文件:
- 申请表原产国批准证书、ISO 13485证书、免费销售证书设备描述研究信息:临床前试验、不良事件报告、临床获益风险报告产品技术要求型式试验使用说明和标签临床研究计划与伦理委员会的协议
申请临床研究的官方费用为 5,3k 欧元,技术审查大约需要 60 个工作日。
中国临床评价展望(2021)
45%的医疗器械组免于临床评价。 42, 5% 的医疗器械需要临床评估,而只有 12, 5% 的医疗器械需要进行临床研究。
中国权威机构解释了7个产品组的CER途径
2022年5月,CMDE发布产品组临床评估途径通知。根据市场上的最佳实践,中国当局在 7 个清单中明确说明了每个产品代码应选择哪个 CER 通路。
列出的 7 个产品组:
· 11 医疗器械消毒灭菌装置
· 12个有源植入设备
· 13 种无源植入设备
· 14 注射、护理和保护装置
· 15个病人承载装置
· 17 种牙科器械
· 22台临床检查仪器
在列表中解释了这些项目:
· 产品代码
· 产品描述
· 有可能的使用
· 例子
· 产品分类
· 途径:
1. 基于豁免目录的 CER
或者
2. 基于等效或类似设备的 CER
或者
3.或4.海外或国内临床研究
作为 13-xx-xx 无源植入设备的示例,在列表中选择了 18 个产品代码用于临床研究(途径 3 或 4),20 个产品代码基于等效设备的临床评估(途径 2)。 14个产品代码免于临床评价(途径1)。列出的 52 个产品代码均属于 III 类医疗器械。
在我们的博客中,我们列出了该组下临床研究所需的所有医疗器械产品代码。
中文 CER 的 E-Learning

服务:CER 即服务 临床研究 CER 和临床研究计划的差距分析
联系我们 。