中国医疗器械检验
典型中国特色和具有挑战性的检验
型式试验是中国独有的,也称为国内试验或产品/样品试验。在俄罗斯和巴西 (ANATEL) 也可以找到类似的测试。
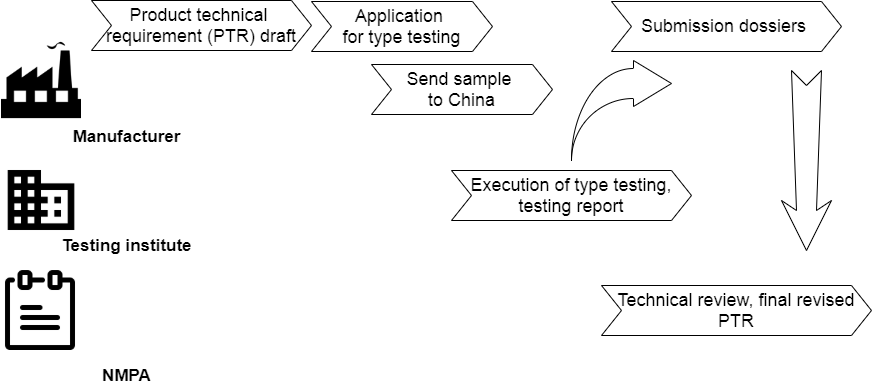
除了在产品注册时准备纸质提交资料外,外国医疗器械还必须在起草产品技术要求(PTR)后送至中国认可的检测机构,如图1所示。型式试验适用于II类和III类医疗器械.最终检测报告是提交档案中的重要文件之一。修订后的PTR及功能规范将由主管部门审核,并在产品批准后与NMPA证书一起作为附件签发。
生物相容性报告、临床前研究、保质期验证报告、包装验证报告超出了型式试验,这些报告经常被 NMPA 接受。
型式测试的工作流程显示了一个非常长的过程,可能会占用整个产品注册过程中三分之一的时间和精力。型式试验的输入由合法制造商起草 PTR。经检测机构确认后,医疗器械可运往中国。通常最好选择一位技术娴熟的工程师和一位汉语口语专家陪同考试。他们可以操作医疗设备并在测试时直接回答问题。平行等待检测报告,制造商可以开始准备主要提交档案。 NMPA的技术审查也将证明检测报告和修改后的PTR。
如果顺利完成型式试验,就好像完成了中国产品注册“马拉松”中最艰难的一段!
New
自2021年起,合格的自有或第三方检测机构的型式检测和检测报告均被NMPA接受
检验的程序、时间、费用和文件
1. 程序
图 2 中显示了型式测试中的重要步骤。联系人主要是检测机构的检测工程师。即使在 NMPA 进行技术审查期间,审查员也会与测试工程师就测试细节进行交流。型式试验申请后,起草的 PTR 将由检测机构评估,然后合法制造商与他们签订协议。
然后海外制造商可以准备样品进行测试,将其进口到中国,甚至可以在本国模拟困难测试场景的样品进行预测试。通常由于对测试的要求很高,直到类型测试的确切日期有很长的等待时间。
2.时间
型式测试前排队等候时间
型式试验申请后:3-6 个月,取决于检测机构。
并不是所有的医疗器械都在检测机构的能力范围内。在这种情况下,制造商应向中央 NMPA 申请授权该测试到测试机构,申请时间约为 1 个月。
型式试验时间:3-6个月,视产品类型而定
* 时间可能会更长,以防万一。在制造商的现场有无法预料的故障排除。总是有不同的测试单元队列,它们必须相互跟随,而不是并行测试。
平均而言,独立软件和无源 MD 的测试比电气医疗设备耗时少。最后一项,安全和电磁兼容的现场测试必须在不同的测试单元中进行。
3.费用
类型测试变体的成本在 5k-20k 欧元之间,具体取决于产品类型和测试机构。
4. 文件
- PTR 使用说明(中文)标签(中文)
有源电气医疗设备:
- IEC 60601-1和IEC 60601-1-2报告关键部件证书EMC内容(产品部件、电源线、关键部件清单、测试配套附件)电气原理图电路图
关于检验的一些问题、想法甚至憧憬
如果没有特定于产品的指南或标准,则无法完全理解哪些关键性能规范对于型式测试至关重要。不同检测机构所专注的核心范围也明显不同。这会导致在型式测试过程中出现一些“不合理”的故障排除。寻找具有感兴趣产品组经验的可靠咨询合作伙伴,并与测试机构建立强大的网络。
目前,NMPA 意识到型式试验不可避免的缺点。他们试图放宽政策,允许更多合格的第三方检测机构介入,并在新通知中接受自我检测报告。希望有朝一日,通过接受认可测试实验室的大部分或全部海外测试报告,型式测试的范围将缩短或取消。预计中国制造商的医疗器械检测报告也将获得全球权威机构的认可。
PTR和型式试验是典型的“中国制造”。对于海外厂商来说,在中国的产品注册过程中,这种测试是绝对的减速。毫无疑问,这主要是对海外厂商的看法,主要是内部验证测试和外部测试实验室进行的其他测试所涵盖的重复测试甚至淘汰。但是,确实存在一些中国标准和国际标准的差异,这需要额外的要求。