在中国/欧洲进行外包测试
Tags: outsourced testing, verification and validation, clinical trial with multicentres, medical device, CNAS, ISO 17025, ASCA-Accredited, tetsing in China, 器械检验,欧洲临床检验,CE证书

中国测试的背景
您是否为医疗器械、体外诊断器械、医疗部件或无线设备的中国测试而头疼?由于缺乏专业的支持、沟通和监控,测试总是出乎意料,困难重重。这浪费金钱和时间,有时甚至比注册时花费的时间还要多、时间也更长。
众所周知,型式测试是中国注册的一个重要部分。您必须将产品送至经过认证的测试实验室或机构。实际上,在某些情况下,您需要更多实验室来进行不同的微生物、化学和环境测试。
未知的是,越来越多的中国实验室和机构获得认证(CNAS、ISO 17025、ISO 9001 和 ISO 13485)。您可以快速制定符合国际标准的计划。凭借英文报告,您可以服务于不同的市场(美国、欧盟、亚洲、拉丁美洲)。因此,不要将您对成品医疗器械测试的满意度限制在测试范围之内。对于医疗组件、无线部件和包装,您总是可以在开发阶段或上市前阶段找到节省成本、质量上乘的中国实验室,最好不要在提交前短暂寻找。
在中国进行外包测试的好处
将中国测试外包是值得的。您无需为自己的研发部门或项目管理付出努力。我们拥有经过认证的中国测试实验室和机构。即使没有,我们也可以根据您的需要进行研究,找到所需的实验室并根据您的质量管理要求检查任何新的合作伙伴。
外包测试有以下一些好处:
· 减轻自身研发负担
· 符合中国或国际标准,或两者兼有
· 中国认证实验室和机构的工具
· 具备测试知识的项目管理
· 优化汉语考试SOP
· 国内外双语交流
· 陪同当地测试和故障排除
· 海外培训,了解你的产品
· 快速且节省成本的项目
· 支持与经销商或中国代理商或权威机构的任何后续行动
· 通过查看最终报告来利用全球注册
服务及其他
我们列出了执行测试的基本标准。询问我们您想要测试的国际标准,我们将匹配测试实验室和机构。
- IEC 80601 系列
- IEC 61010 系列
- IEC 61326 系列
- GB/T 14170
- IEC 62133, UN38.3
- ROHS、REACH
- GB/T 25000.51
- ISO 11135、ISO 11137、ISO 17665
- GB 16886系列(对应ISO 10993系列)
- GB 9706系列(2023年5月起生效)对应IEC 60691系列
- SRRC、NCC、FCC、MIC 测试
- 加速和实时老化
联系我们, 在我们的任何国际合作实验室进行测试
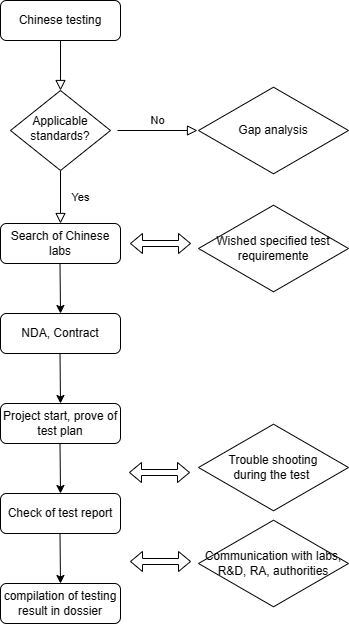
医疗器械委托检测工作流程
以下是基本工作流程。在我们的报价中,我们将具体说明测试的责任、时间、成本和里程碑会议。
在欧洲进行测试
欧洲许多认证实验室(通过 ISO 17025 认证或认证机构测试实验室或 FDA 合格评定认可计划)的测试可用于中国和全球注册。在注册准备之外进行测试项目是有意义的,因为它可以同时执行,并且通常需要比预期更长的时间。
我们也可以支持您在欧洲进行测试,因为我们有许多合作实验室,他们拥有被不同机构认可的良好报告。
最近,中国实验室的质量和真实性正在下降,尤其是 FDA。在收到警告后,中国制造商委托欧洲进行医疗器械测试是合理的。
我们可以
· 陪同从测试计划到最终测试报告的审查
· 针对国家监管要求的测试摘要版本
· 回答不同内部机构和公告机构的缺陷答复(或附加要求)
· 拥有生命周期控制何时重复测试或修改测试摘要
一般测试
- 化学成分
- 表面分析(XPS、SEM、EDX)
- 工艺验证(灭菌、消毒、洁净室、冷冻干燥、化学合成和净化)
生物学评估
· 生物相容性(ISO 10993 – 和ISO 18562系列)
· 毒理学
· 致突变性
· 遗传毒性
- DIN EN 13795 for surgical textiles
- DIN EN 14683 or FFP masks according to DIN EN 149
- AAMI ST98
医疗保健产品清洁验证—医疗器械清洁过程的开发和验证要求。
- VV 40 – 2018
通过验证和确认评估计算建模的可信度:应用于医疗器械
定制实验室测试
根据设备、IVD或组件,您需要进行特殊测试,而无需遵循标准。我们可以开发测试方法来识别问题
根据 ISO 14155:2020 进行临床研究
可以是多中心的国际医疗器械临床研究,欧洲临床试验的优势是来自欧洲患者的真实数据。



