关于NMPA及中国医疗器械市场趋势
标签: 中国权威, NMPA, 医疗器械, 体外诊断试剂 (IVD), CMDE, 医疗器械立法, 国务院 2021 年第 739 号令(原 680 号令), 产品特定指南, 中国标准 (GB, GB /T, YY and YY/T), GB 9706.1-2020, YY 9706.102-2021, 医疗器械定义, 上市许可持有人(=注册人=合法制造商), NMPA趋势, 不良事件报告
1. 中国医疗器械与体外诊断管理局
2018年国家药品监督管理局(NMPA,中文:国家药品监督管理局)取代原中国食品药品监督管理局(CFDA)。作为国家市场监督管理总局(SAMR)的一部分,国家药监局负责中国药品、医疗器械和化妆品的监管工作。国家药监局的核心任务是起草药品、医疗器械和化妆品立法并监督法规的实施。除此之外,NMPA还负责标准、质量管理、注册和上市后活动,包括对上述产品的检验。
在国家药监局的中心中,中国医疗器械评价中心(CMDE)对医疗器械进行技术评价。它的作用与美国 FDA 的器械和放射健康中心 (CDRH) 非常相似。
CMDE是海外制造商在审批过程中与之沟通的准联络机构。 CMDE 缩写也用于产品特定的指导并参与检查。
英国法规
CMDE 网站只有一个注册流程,NMPA 有一个简短的英文网站。
2. 中国医疗器械与体外诊断法规
我国医疗器械立法正在快速发展。 《医疗器械监督管理条例》已经2020年底国务院第119次常务会议修订通过,自2021年6月1日起施行。此后,各种规定、通知和技术指南相继出台,在中国标识的医疗器械的整个生命周期内都应遵守和遵循。
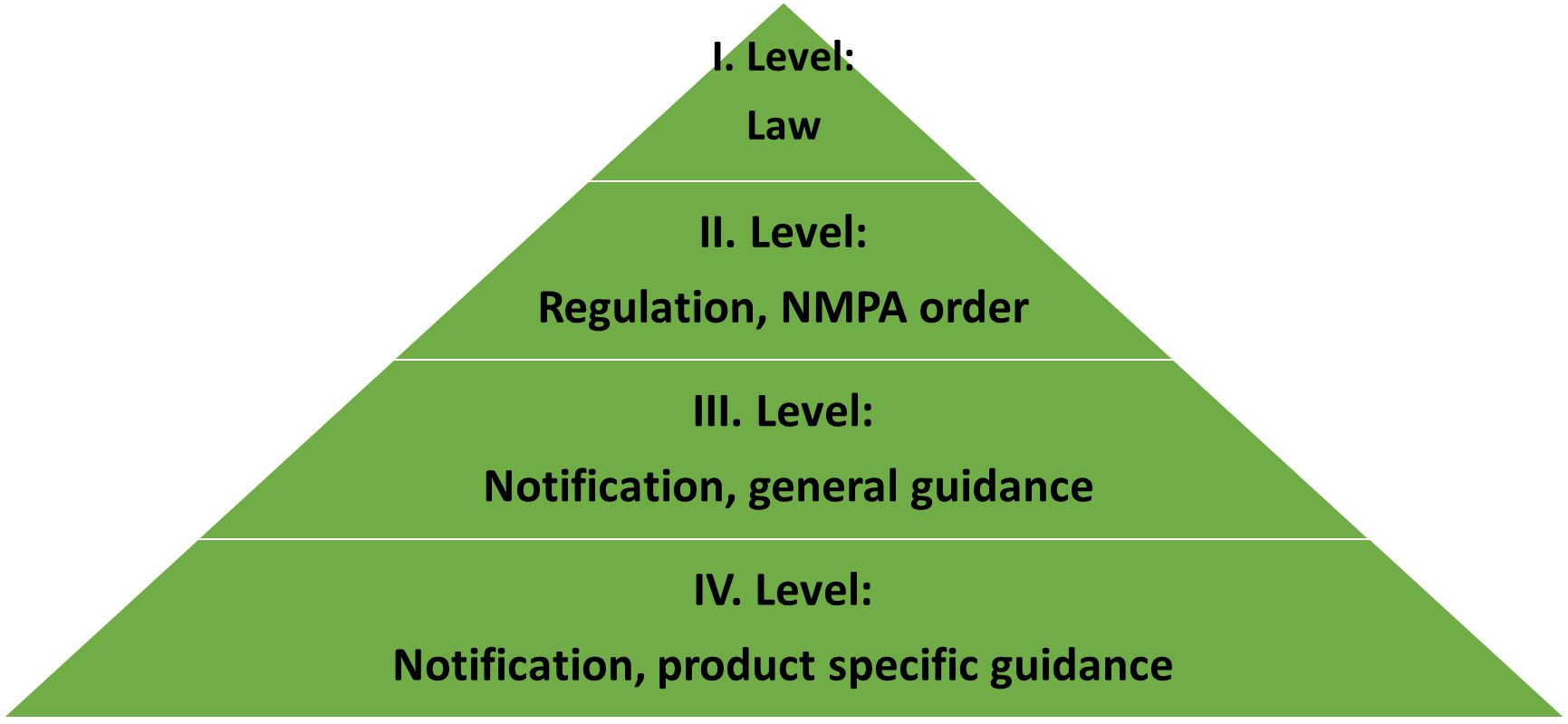
中国的医疗器械立法是如何建立起来的?
第一级别:法律
《医疗器械监督管理条例》(国务院令第 739 号)与欧盟 2017/745(医疗器械法规,MDR)或美国 FD&C 法案具有同等法律效力。国务院令 739 号总结极其紧凑(739 号有 2 万个汉字和 107 篇文章,而欧盟 MDR 中有 10 万个英文单词和 123 篇文章),只有注册、制造、批准后销售、不良事件和不良事件等 8 章。召回、批准后监督为医疗器械检查和法律责任。
第二等级:法规,NMPA令
对产品注册、使用说明、产品分类、不良事件和医疗器械境外检验等方面的要求进行了明确的支持性通则(或规定)。
医疗器械注册备案管理办法(2021年第47号)
体外诊断设备登记备案管理办法(2021年第48号)
医疗器械生产监督管理办法 (2022第53号)
医疗器械注册质量管理体系核查指南 (2022年第50号)
医疗器械使用说明和标签(2014 年第 6 号)
医疗器械的不良事件监测和重新评估(2018第1号)
医疗器械质量管理体系年度自查报告编写指南(2022年第13号)
第三级别:通知,一般指导
实际上,CMDE发布的这些通常是产品注册的指南。
医疗器械临床评价(2021 年第 73 号)
IVD 的临床评估(2021 年第 74 号)
医疗器械境外临床试验数据审批(2018年第13号)
体外诊断试剂境外临床试验数据审批(2021年95号)
医疗软件技术审查(2022 年第 9 号)
医疗器械网络安全技术审查(2022年第7号)
医疗器械产品技术要求(PTR)(2014 年第 9 号)
第四级别:通知、产品特定指导
为了区分一般指南,有与大多数产品代码匹配的产品特定指南。
如果您有产品代码的前 4 位数字或感兴趣产品的总组,您可以搜索相应的产品特定指南和标准。
三、中国医疗器械与体外诊断标准
国家(GB)和行业(YY)标准中国标准有两种:国家标准化管理委员会(SAC)发布的国家(GB)和NMPA发布的行业(YY)。非绑定或推荐字符具有前缀 /T。没有 /T 意味着强制。总体而言,中国标准的版本处于开发阶段。大多数中国标准与旧版国际协调标准相匹配。与国际标准相比,共有三类:相同(IDT)、等效(EQV)或非等效(NEQ)。
新的(状态:01,2023):
目前国家标准235项(强制性91项,推荐性144项),行业标准1614项(强制性298项,推荐1316项)
例子
新 GB 9706.1-2020(2023 年 5 月生效,替代 GB 9706.1-2007):IEC 60601-1:2012,医用电气设备——第 1 部分:安全通用要求
NEW YY 9706.102-2021(2023年5月生效,替代YY 0505-2012):IEC 60601-1-2:2007,医用电气设备-第1-2部分:安全通用要求-并列标准:电磁兼容性-要求和测试
YY/T 0316-2016:ISO 14971:2007,风险管理在医疗器械中的应用
NMPA每年都会制定修订或新的医疗器械行业标准的计划。这意味着所申请的产品必须在所有三种类型的产品注册(初始注册、变更注册和延期注册)中都符合新标准。
如果新的强制性国家或行业标准适用于医疗器械,通常必须进行至少一次增量型式试验才能满足新要求。它类似于针对每个制造商的 IEC 60601 系列医疗电气标准的国际修订。
同样,GB 9706.1-2020 将于 2023 年生效。截至 2023 年 5 月,所有医疗电气设备都必须在测试时满足新的安全要求,然后才能投放市场。最后,一项重要的中国标准达到了国际艺术水平。
四、中国医疗器械的定义
定义
医疗器械监督管理条例(国务院令2021/739)
第一百零三条
医疗器械是直接或间接与人体接触的仪器、设备、器具、体外诊断试剂及其校准品、材料和其他类似或相关物品,包括必要的计算机软件;主要通过物理方式获得疗效,除药理学、免疫学或代谢途径外,或这些途径参与但仅起辅助作用;用于实现以下预期结果:
- 疾病的诊断、预防、监测、治疗或缓解 损伤的诊断、监测、治疗、缓解或功能补偿 生理结构或生理过程的检查、替代、调节或支持 生命支持或维持生命 避孕控制 人体样本检查为医疗或诊断目的提供信息
医疗器械注册人和记录持有人
第三十四条
可以自行生产医疗器械,也可以委托符合本规定要求并具备相应条件的企业生产医疗器械。
第一百零三条
指取得医疗器械注册证或者办理医疗器械备案的企业或者研究机构。
医疗器械注册人、备案人是指一类、二类、二类医疗器械上市许可持有人(MAH)。与合法制造商相同,这意味着 MAH 拥有医疗器械的完整授权书。
五、2021年NMPA注册趋势
新注册产品
初始注册为 1710(与 2020 年相比增加 8.8),变更注册为 2665(与 2020 年相比 -3.1%)和续订 6939(与 2020 年相比增加 25.6%)
国内获批三类医疗器械3097件,体外诊断1517件。国外排名前5位的省份分别是江苏、广东、北京、上海和山东,占国内医疗器械和体外诊断总量的67.9%。
获批进口三类医疗器械3649件,体外诊断3069件。国外排名前5位的国家是美国、德国、日本、韩国和瑞士,占72个,占进口医疗器械和体外诊断的5%。
国内批准的Ⅱ类医疗器械为31509件。国外排名前5位的省份分别是广东、江苏、北京、湖南、浙江,占国内医疗器械和IVD总量的67.9%。
获批进口二类医疗器械2759件,体外诊断469件。国外前5位分别是美国(158件)、德国(126件)、日本(71件)、韩国(34件)和瑞士(31件),占72件,占总数的5%进口医疗器械和IVD。
批准的国产I类医疗器械26773件,进口I类医疗器械1854件。
国内医疗器械前5大类产品(共22个产品大类):
01 主动式手术器械 (64, +48.8%)
03 神经和心血管外科器械 (128, +54.2%)
06 医疗影像设备 (91, +13.8%)
13 种被动植入设备 (237, +3.9%)
14 注射、护理和保护装置 (158, +32.2%)
进口医疗器械前5大产品组(共22个):
03 神经和心血管外科器械 (36)
06 医疗影像设备 (70, +11.1%)
13 种被动植入设备 (48, +17.1%)
16 眼科设备 (33)
17 牙科器械 (41)
*以上注册人数的增长与 2020 年相比。
眼科器械和牙科器械市场以进口医疗器械为主。在共同的顶级产品组中,神经和心血管手术器械和无源植入器械在国内占据主导地位。
2021年中国标准趋势
有了这样的节奏和质量,医疗器械的开发和技术文件就有了与之相适应的“艺术立场”。符合中国标准的医疗器械获得世界认可只是时间问题。
2021年总结
新发布的国家标准35项,行业标准146项(另有3项修订)。尚计划修订国家标准38项,行业标准79项。迄今为止,我国共有医疗器械和体外诊断标准1849项。
国际趋势
由中国发起,发布了2项国际标准:
- ISO 22679-2021 心血管植入物 - 经导管心脏封堵器ISO 80601-2-90:2021 医用电气设备 - 第 2-90 部分:呼吸高流量治疗设备基本安全和基本性能的特殊要求
启动新的国际标准项目:
《计算机断层扫描设备能谱成像性能评价方法》、《外科器械吻合器第1部分:术语和定义》、《外科器械吻合器第2部分:一般要求》、《胶原蛋白特征肽定量测定标准》、《标准》用于定量测定脱细胞基质支架中的残留 DNA”
积极推动制定的国际标准:
- ISO 8536-15:2022 医用输液设备 - 第 15 部分:一次性使用的光保护输液器 ISO/DTS 24560-1 组织工程医疗产品 - 软骨的 MRI 评估 - 第 1 部分:使用延迟的再生膝关节软骨的临床评估钆增强软骨 MRI (dGEMRIC) 和 T2 标测
全国医疗器械不良事件监测年度报告(2021)
在此,我们揭示了中国医疗器械不良报告的关键数字和我们观察到的趋势。
• 2021年,全国医疗器械不良事件监测信息系统共接收医疗器械不良事件报告65万余件,平均每百万人口报告461件,比上年增长21.39%。

- 2021年,国家药品不良反应监测中心受理的医疗器械不良事件报告中,用户(一般为医院)报告562928件,占报告总数的86.52%;注册人(通常是制造商)将报告14853件,占报告总数的2.28%;经销商报告72567份,占报告总数的11.15%;其他来源举报347件,占举报总数的0.05%。

- 死亡报告163例,占报告总数的0.03%;报告重伤36610件,占总数的5.63%;其他伤害报告613922件,占报告总数的94.35%
- 第三类医疗器械报告224287件,占报告总数的34.47%;涉及第二类医疗器械的报告305645件,占报告总数的46.97%;涉及第一类医疗器械的报告57108件,占报告总数的8.78%

• 涉及被动医疗器械的报告423018件,占报告总数的65.01%。涉及有源医疗器械的报告159212件,占报告总数的24.47%;涉及体外诊断试剂的报告4794件,占报告总数的0.74%
• 使用“医疗机构”的举报569693篇,占举报总数的87.55%。使用“家庭”的举报67369条,占举报总数的10.35%;使用“其他”的报表13633篇,占13633篇。占报告总数的 2.10%
趋势
在中国,不良事件的报告正在增加。大约 87% 的不良事件由医院登记,这些医院承担着制造商现场未主动报告不良事件的情况。只有 6% 的已登记不良事件被归类为严重不良事件,这意味着大多数报告的不良事件实际上只是对患者安全没有严重影响的投诉。