À propos de la NMPA et de la tendance du marché chinois des dispositifs médicaux
Balises : Autorité chinoise, NMPA, dispositif médical, Réactif de diagnostic in vitro (DIV), CMDE, législation sur les dispositifs médicaux, Ordonnance du Conseil d'État n° 739 en 2021 (ancienne ordonnance 680), Directives spécifiques au produit, Normes chinoises (GB, GB/T, YY et YY/T), GB 9706.1-2020, YY 9706.102-2021, définition de dispositif médical, Titulaire de l'autorisation de mise sur le marché (=registrant=légal fabricants), tendance NMPA, déclaration d'événements indésirables
1. Autorité chinoise des dispositifs médicaux et IVD
En 2018, l'Administration nationale des produits médicaux (NMPA, chinois :国家药品监督管理局) a remplacé l'ancienne administration chinoise des aliments et médicaments (CFDA). En tant que partie intégrante de l'Administration d'État pour la réglementation du marché (SAMR), la NMPA est chargée de la supervision des médicaments, des dispositifs médicaux et des cosmétiques en Chine. La tâche principale de la NMPA est de rédiger une législation sur les médicaments, les dispositifs médicaux et les cosmétiques et de superviser la mise en œuvre des réglementations. En outre, la NMPA est également responsable des normes, de la gestion de la qualité, de l'enregistrement et des activités post-commercialisation, y compris l'inspection des produits susmentionnés.
Parmi les centres de la NMPA, l'évaluation des dispositifs médicaux chinois (CMDE) effectue une évaluation technique des dispositifs médicaux. Son rôle est assez similaire à celui du Center for Devices and Radiological Health (CDRH) de la FDA aux États-Unis.
CMDE est quasi l'autorité de contact pendant le processus d'approbation avec laquelle les fabricants étrangers communiquent. Le CMDE paraphe également des directives spécifiques aux produits et participe aux inspections.
Règlement anglais
Il n'y a qu'un seul processus d'enregistrement sur le site Web du CMDE et un bref site Web en anglais de la NMPA.
2. Réglementation chinoise sur les dispositifs médicaux et le DIV
La législation sur les dispositifs médicaux se développe à un rythme rapide en Chine. Le règlement sur la gestion de la surveillance des dispositifs médicaux a été révisé et approuvé lors de la 119e réunion exécutive du Conseil d'État fin 2020 et est valable le 01.06.2021. Depuis lors, diverses dispositions, notifications et directives techniques sont publiées et doivent être respectées et suivies tout au long du cycle de vie des dispositifs médicaux marqués en Chine.
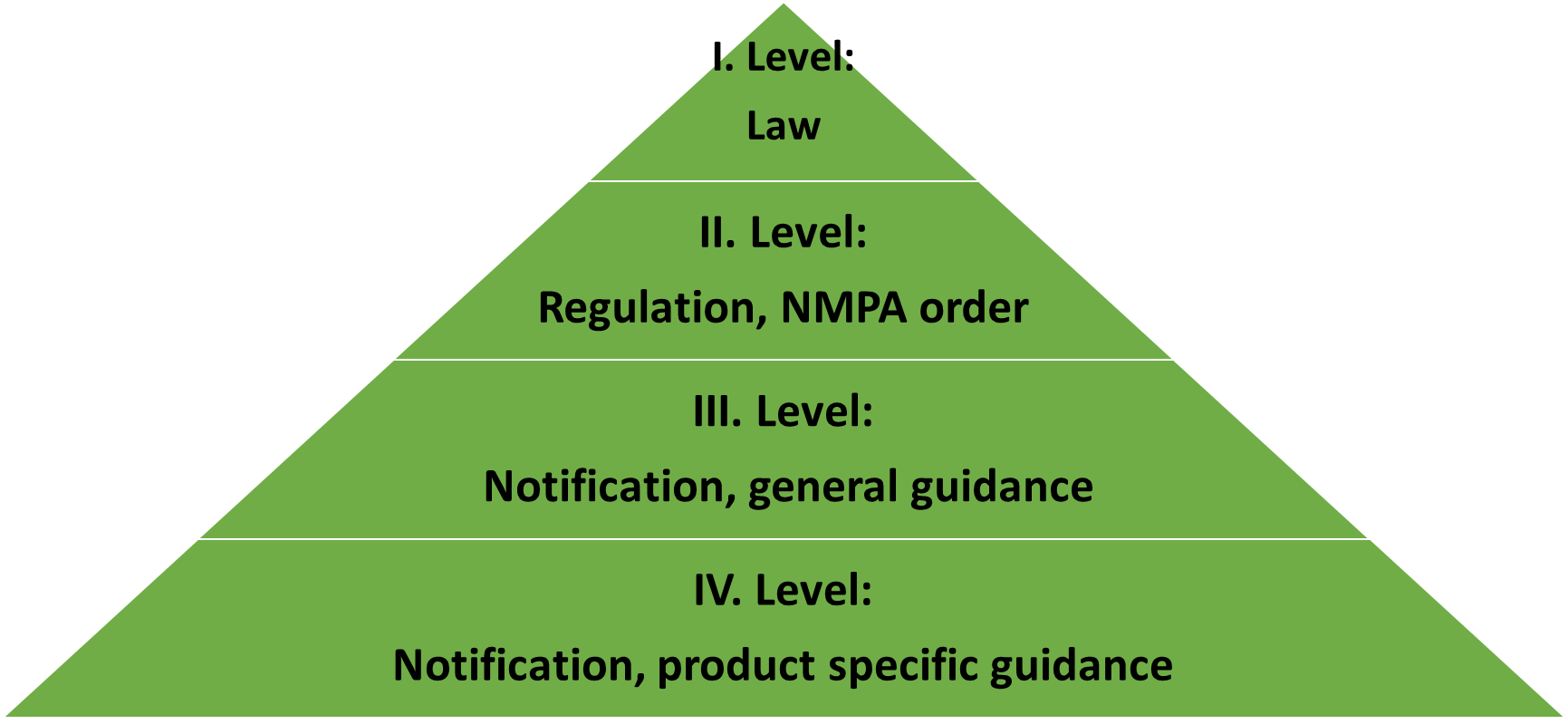
Comment se construit la législation sur les dispositifs médicaux en Chine ?
I. Niveau : Droit
Le « Règlement sur la supervision et l'administration des dispositifs médicaux » (Ordonnance du Conseil d'État n° 739) a le même rôle juridique que le 2017/745 (Medical Device Regulation, MDR) dans l'UE ou la loi FD&C aux États-Unis. L'ordonnance du Conseil d'État n° 739 est extrêmement concise (20 000 caractères chinois et 107 articles dans le n° 739 contre 100 000 mots anglais et 123 articles dans le MDR de l'UE) et ne comporte que 8 chapitres contenant l'enregistrement, la fabrication, les ventes après approbation, les événements indésirables et le rappel, après la supervision de l'approbation en tant qu'inspections et responsabilité légale du dispositif médical.
II. Niveau : Réglementation, Ordonnance NMPA
Il existe de nombreuses ordonnances (ou dispositions) générales de soutien clarifiant les exigences d'enregistrement des produits, les instructions d'utilisation, la classification des produits, les événements indésirables et l'inspection à l'étranger des dispositifs médicaux.
Mesures de gestion de l'enregistrement et du dépôt des dispositifs médicaux (arrêté 47, 2021)
Mesures de gestion de l'enregistrement et du dépôt du DIV (ordonnance 48, 2021)
Mesures de surveillance et d'administration de la production de dispositifs médicaux (arrêté 53, 2022)
Lignes directrices pour l'inspection du système de gestion de la qualité pour l'enregistrement des dispositifs médicaux (commande 50, 2022)
Mode d'emploi et étiquettes des Dispositifs Médicaux (Ordonnance 6, 2014)
Surveillance des événements indésirables et réévaluation des dispositifs médicaux (Ordonnance 1, 2018)
Lignes directrices pour la rédaction du rapport annuel d'auto-examen du système de gestion de la qualité des dispositifs médicaux (ordonnance 13, 2022)
Inspection à l'étranger des médicaments et des dispositifs médicaux (Ordonnance 101, 2018)
III. Niveau : Notification, conseils généraux
En fait, ces directives émises par le CMDE sont souvent des lignes directrices utiles pour l'enregistrement des produits.
Évaluation clinique des Dispositifs Médicaux (Ordonnance 73, 2021)
Évaluation clinique des DIV (Ordonnance 74, 2021)
Approbation des données d'essais cliniques à l'étranger d'un dispositif médical (Ordonnance 13, 2018)
Approbation des données d'essais cliniques à l'étranger d'un réactif de diagnostic in vitro (Ordonnance 95, 2021)
Revue technique des logiciels médicaux (Arrêté 9, 2022)
Examen technique de la sûreté cybersécurité des Dispositifs Médicaux (Ordonnance 7, 2022)
Exigence technique du produit (PTR) du dispositif médical (Ordonnance 9, 2014)
IV. Niveau : notification, conseils spécifiques au produit
Pour différencier les conseils généraux, il existe des conseils spécifiques au produit correspondant à la plupart des codes de produit.
Si vous disposez des 4 premiers chiffres du code produit ou du groupe général de produits intéressés, vous pouvez rechercher les directives et normes spécifiques au produit correspondantes.
3. Normes chinoises de dispositifs médicaux et DIV
Normes nationales (GB) et industrielles (YY) Le caractère non contraignant ou recommandé a le préfixe /T. Sans /T, cela signifie obligatoire. En général, la version des normes chinoises est en phase de développement. La plupart des normes chinoises correspondent à l'ancienne version ou à l'édition des normes internationales harmonisées. Il existe trois catégories par rapport aux normes internationales : identiques (IDT), équivalentes (EQV) ou non équivalentes (NEQ).
Exemple
NOUVEAU GB 9706.1-2020 (valide à partir de mai 2026, remplaçant GB 9706.1-2007)
Correspondant à la CEI 60601-1:2012, édition 3, Appareils électromédicaux — Partie 1 : Exigences générales de sécurité
NOUVEAU YY 9706.102-2021 (valide à partir de mai 2026, remplaçant YY 0505-2012)
Correspondant à la CEI 60601-1-2:2007, édition 3, Appareils électromédicaux-Partie 1-2 : Exigences générales de sécurité-Normes collatérales : Compatibilité électromagnétique-Exigences et essais
Nouveau GB/T 16886.1-2022 (valide à partir de mai 2023)
Correspondant à la norme ISO 10993-01 : 2018, Évaluation biologique des dispositifs médicaux — Partie 1 : Évaluation et essais dans le cadre d'un processus de gestion des risques
AA/T 0316-2016
Correspondant à la norme ISO 14971:2007, Application de la gestion des risques aux dispositifs médicaux
GB/T 25000.51-2016 Ingénierie des systèmes et des logiciels―Exigences et évaluation de la qualité des systèmes et des logiciels (SQuaRE)―Partie 51 : Exigences relatives à la qualité du produit logiciel prêt à l'emploi (RUSP) et instructions de test
Chaque année, la NMPA élabore un plan de révision ou de nouvelles normes industrielles relatives aux dispositifs médicaux. Cela signifie que les produits appliqués doivent être conformes aux nouvelles normes dans les trois types d'enregistrement de produit (enregistrement initial -, changement - et extension).
Si une nouvelle norme nationale ou industrielle obligatoire s'applique à un dispositif médical, très souvent, au moins un essai de type delta doit être entrepris pour répondre aux nouvelles exigences. Il est similaire à une révision internationale des normes électromédicales comme la série CEI 60601 pour tous les fabricants.
De même, le GB 9706.1-2020 sera prolongé en 2026. À partir de mai 2026, tous les équipements électromédicaux doivent satisfaire aux nouvelles exigences de sécurité lors des tests, puis pouvoir être mis sur le marché. Enfin l'une des normes chinoises importantes atteint le stand international de l'art.
4. Définition du dispositif médical en Chine
Définition
Règlement sur la surveillance et l'administration des dispositifs médicaux (arrêté du Conseil d'État 2021/739)
103
Un dispositif médical est un instrument, un équipement, un appareil, un réactif de diagnostic in vitro et son calibrateur, du matériel et d'autres articles similaires ou pertinents, y compris les logiciels informatiques nécessaires, en contact direct ou indirect avec le corps humain ; l'efficacité est obtenue principalement par des moyens physiques autres que les voies pharmacologiques, immunologiques ou métaboliques, ou que ces voies interviennent mais ne jouent qu'un rôle auxiliaire ; qui est utilisé pour atteindre les résultats escomptés suivants :
- Diagnostic, prévention, surveillance, traitement ou atténuation de maladies Diagnostic, surveillance, traitement, atténuation ou compensation fonctionnelle d'une blessure Examen, substitution, régulation ou soutien d'une structure physiologique ou d'un processus physiologique Maintien de la vie ou maintien de la vie Contrôle de la contraception Examen de l'échantillon du corps humain pour fournir des informations à des fins médicales ou de diagnostic
Inscrit et titulaire du dossier d'instrument médical
Article 34
peuvent produire eux-mêmes des dispositifs médicaux ou confier la production de dispositifs médicaux à des entreprises qui satisfont aux exigences de ces réglementations et disposent des conditions correspondantes.
103
faire référence à l'entreprise ou à l'institution de recherche qui a obtenu le certificat d'enregistrement du dispositif médical ou qui a géré le dossier du dispositif médical.
Le titulaire de l'enregistrement et le titulaire du registre du dispositif médical font référence au titulaire de l'autorisation de mise sur le marché (TAMM) du dispositif médical de classe I, II et II. C'est la même chose que le fabricant légal, ce qui signifie que MAH a une pleine procuration pour le dispositif médical.
5. Tendance des inscriptions au NMPA en 2022
Nouveaux produits enregistrés
Les inscriptions initiales sont de 2500 (+46,2% par rapport à 2021), les inscriptions de changement 4224 (+58,5% par rapport à 2021) et les renouvellements 5281 (-24,8% par rapport à 2021)
Les dispositifs médicaux domestiques de classe III approuvés sont 5425 et IVD 1287.
Les dispositifs médicaux importés de classe III approuvés sont 2377 et IVD 302.
Les dispositifs médicaux domestiques de classe II approuvés sont 1590 et IVD 877.
Les dispositifs médicaux domestiques de classe II approuvés sont 32889 !
Top 5 des pays étrangers et principales catégories de produits
Les 5 premiers pays étrangers sont les États-Unis (226+), l'Allemagne (117-), le Japon (69-), la Corée (42+) et la France (26, nouveau) qui couvrent 76,4 % du total des importations de dispositifs médicaux et de DIV.
Top 5 des catégories de produits (total de 22 catégories de produits) de dispositifs médicaux domestiques :
13 Dispositifs Implantables Passifs (400, +68,4%)
03 Dispositifs Chirurgicaux Neurologiques et Cardiovasculaires (246, +92,2%)
14 Dispositifs d'injection, d'allaitement et de protection (168, +6,3%)
06 Appareils d'imagerie médicale (162, +78%)
01 Dispositifs Chirurgicaux Actifs (113, +76,6%)
Les 5 principaux groupes de produits (22 catégories de produits au total) des dispositifs médicaux importés :
06 Dispositifs d'Imagerie Médicale (75, +7%)
13 Dispositifs Implantables Passifs (53, +10,4%)
14 dispositifs d'injection, d'allaitement et de protection (50, nouveaux)
17 Instruments dentaires (45, +9,7%)
03 Dispositifs Chirurgicaux Neurologiques et Cardiovasculaires (43, +19,4%)
L'augmentation des enregistrements ci-dessus est comparée à 2021. La réduction des dispositifs médicaux importés est nette.
Dans les 5 premiers groupes de produits de l'examen du numéro d'enregistrement, il n'est pas remarquable de dominer le produit importé.
Parmi les principaux groupes de produits communs, 13 dispositifs implantables passifs, 03 dispositifs chirurgicaux neurologiques et cardiovasculaires, 14 dispositifs d'injection, de soins infirmiers et de protection et 06 dispositifs d'imagerie médicale ont une domination nationale.