Encyclopédie des dispositifs médicaux et DIV en Chine

Définition officielle
Administration nationale des produits médicaux (NMPA)
En tant que partie intégrante de l'Administration d'État pour la réglementation du marché (SAMR), la NMPA est chargée de la supervision des médicaments, des dispositifs médicaux et des cosmétiques en Chine.
L'évaluation des dispositifs médicaux chinois (CMDE) effectue une évaluation technique des dispositifs médicaux. Son rôle est assez similaire à celui du Center for Devices and Radiological Health (CDRH) de la FDA aux États-Unis.
Ordonnance du Conseil d'État 739
Le « Règlement sur la supervision et l'administration des dispositifs médicaux » (=Ordonnance du Conseil d'État n° 739) a le même rôle juridique que le 2017/745 (Medical Device Regulation, MDR) dans l'UE ou la loi FD&C aux États-Unis. C'est la loi la plus élevée pour les dispositifs médicaux et les DIV.
Dispositif médical
est un instrument, équipement, appareil, réactif de diagnostic in vitro et son calibrateur, matériel et autres articles similaires ou pertinents, y compris les logiciels informatiques nécessaires, en contact direct ou indirect avec le corps humain ; l'efficacité est obtenue principalement par des moyens physiques autres que les voies pharmacologiques, immunologiques ou métaboliques, ou que ces voies interviennent mais ne jouent qu'un rôle auxiliaire ; qui est utilisé pour atteindre les résultats escomptés suivants :
· Diagnostic, prévention, surveillance, traitement ou soulagement de maladies
· Diagnostic, suivi, traitement, atténuation ou compensation fonctionnelle d'une blessure
· Examen, substitution, régulation ou soutien de la structure physiologique ou du processus physiologique
· Aide à la vie ou maintien de la vie
· Contrôle de la contraception
· Examen de l'échantillon du corps humain pour fournir des informations à des fins médicales ou de diagnostic
Les utilisateurs de dispositifs médicaux désignent les institutions qui utilisent des dispositifs médicaux pour fournir des services médicaux et autres services techniques à d'autres, y compris les institutions médicales, les institutions de services techniques de planification familiale, les stations de sang, les stations de plasma d'aphérèse et les institutions d'adaptation des dispositifs d'assistance à la réadaptation.
Le dispositif médical à grande échelle fait référence à un dispositif médical à grande échelle avec une technologie complexe, un investissement en capital important, un coût d'exploitation élevé, un impact important sur les dépenses médicales et inclus dans la gestion du catalogue.
Inscrit du dispositif médical (demandeur) et détenteur du dossier (déposant)
Selon la traduction figurant dans de nombreux règlements, cela signifie fabricant légal pour les classes II et III en tant que déclarant ou demandeur, pour la classe I en tant que détenteur d'enregistrement ou déposant.
agent chinois
est également appelé autorisé - ou représentant dans le pays. Il équivaut à un agent américain ou à une personne responsable britannique. C'est le représentant local en Chine qui soumet le dossier, enregistre l'UDI, signale les événements indésirables et communique avec les autorités chinoises.
Système électronique de produits réglementés (eRPS)
Ce système est une plate-forme pour soumettre la documentation technique électronique à l'autorité en matière d'enregistrement des dispositifs médicaux en Chine.
Le groupe d'événements indésirables d'un dispositif médical fait référence aux événements survenus par le même dispositif médical au cours de son utilisation qui causent des dommages ou
La surveillance des événements indésirables liés aux dispositifs médicaux fait référence au processus de collecte, de notification, d'investigation, d'analyse, d'évaluation et de contrôle des événements indésirables liés aux dispositifs médicaux.
Base de données officielle
Dispositif médical approuvé et DIV

Norme chinoise

Flux de travail d'inscription
Flux d'évaluation (après soumission)

UDI
Événement indésirable et rappel
De nos meilleures pratiques
Modifier l'enregistrement
Si un changement important de produit se produit, vous devez commencer un nouvel enregistrement. Aux États-Unis, on appelle le nouveau 510k. En Chine, cela s'appelle l'enregistrement de changement ou le réenregistrement. Il masque automatiquement que vous fournirez des preuves et décrirez les principaux changements significatifs au dossier. L'enregistrement d'origine sera remplacé par l'enregistrement de modification.
Le changement en matière administrative est une catégorie pour les éléments suivants :
· nom ou adresse du fabricant étranger
· nom ou adresse de l'agent chinois
Essais de type
est unique en Chine, il est également appelé test dans le pays ou test de produit/échantillon. L'appareil doit être envoyé à un laboratoire chinois, selon les normes chinoises, les spécifications sont testées. Pour les dispositifs médicaux électriques actifs, il s'agit généralement de la sécurité - et de la compatibilité électromagnétique.
Rapport annuel d'auto-inspection
Pour les fabricants étrangers, l'agent chinois est responsable de soumettre ce rapport annuel chaque année avant avril. Outre les informations de base sur le dispositif médical approuvé, les chapitres suivants sont nécessaires :
· Changement de conception, de matériau, de composants critiques, de processus de production critique, de contrôle qualité
· Événements indésirables et rappels
· Appareils non conformes
· Toutes sortes d'inspections nationales
· Approvisionnement central
· Sanctions
· Audit interne
Exemple simple
Le code produit est un code à 6 chiffres du catalogue de classification. Il existe 22 catégories principales de produits. En fonction de l'utilisation prévue, le dispositif médical peut être classé dans un code produit précis à 6 chiffres et une classification d'appartenance.
code produit 21-01-01, Logiciel de planification de radiothérapie, classe III.
Certificat chinois
Après approbation par l'autorité, le fabricant légal reçoit un certificat chinois, désormais électronique. Il est valable 5 ans. Attaché au certificat est l'exigence technique du produit.

Numéro de certificat
Délivré par les autorités chinoises après approbation
Dispositif médical de classe II et III
Injection de machines nationales 20162540407
1 : année d'homologation (dans ce cas 2016)
2 : classe de produit (ici 2)
3 : partie du code produit
4 : numéro de série d'enregistrementau NMPA
Dispositif médical de classe I
Équipement national de machines 20160407
Code consommable d'assurance médicale
Le code des consommables d'assurance médicale est divisé en 5 parties avec un total de 20 codes.
1 code : code consommable, C
Code 2-7 : code de classification à 6 chiffres
Code 8-10 : code de nom commun
Code 11-15 : code caractéristique du produit
Code 16-20 : Code de l'entreprise de production

Exigence technique du produit (PTR)
est un document soumis aux instituts de test (ou laboratoires chinois) par les fabricants légaux. Il s'agit d'une partie caractéristique du dispositif médical indiquant toutes les spécifications de performance clés et les méthodes de test dérivées des normes chinoises dans lesquelles les instituts de test vérifient leur propre capacité de test et effectuent des tests de type.
voir un exemple

Rapport périodique d'évaluation des risques (PERE)
C'est comme le PSUR européen. Pour les dispositifs médicaux de classe II et III, le PRER doit être soumis par voie électronique chaque année après la date d'approbation initiale jusqu'à la première extension d'enregistrement.
voir modèle
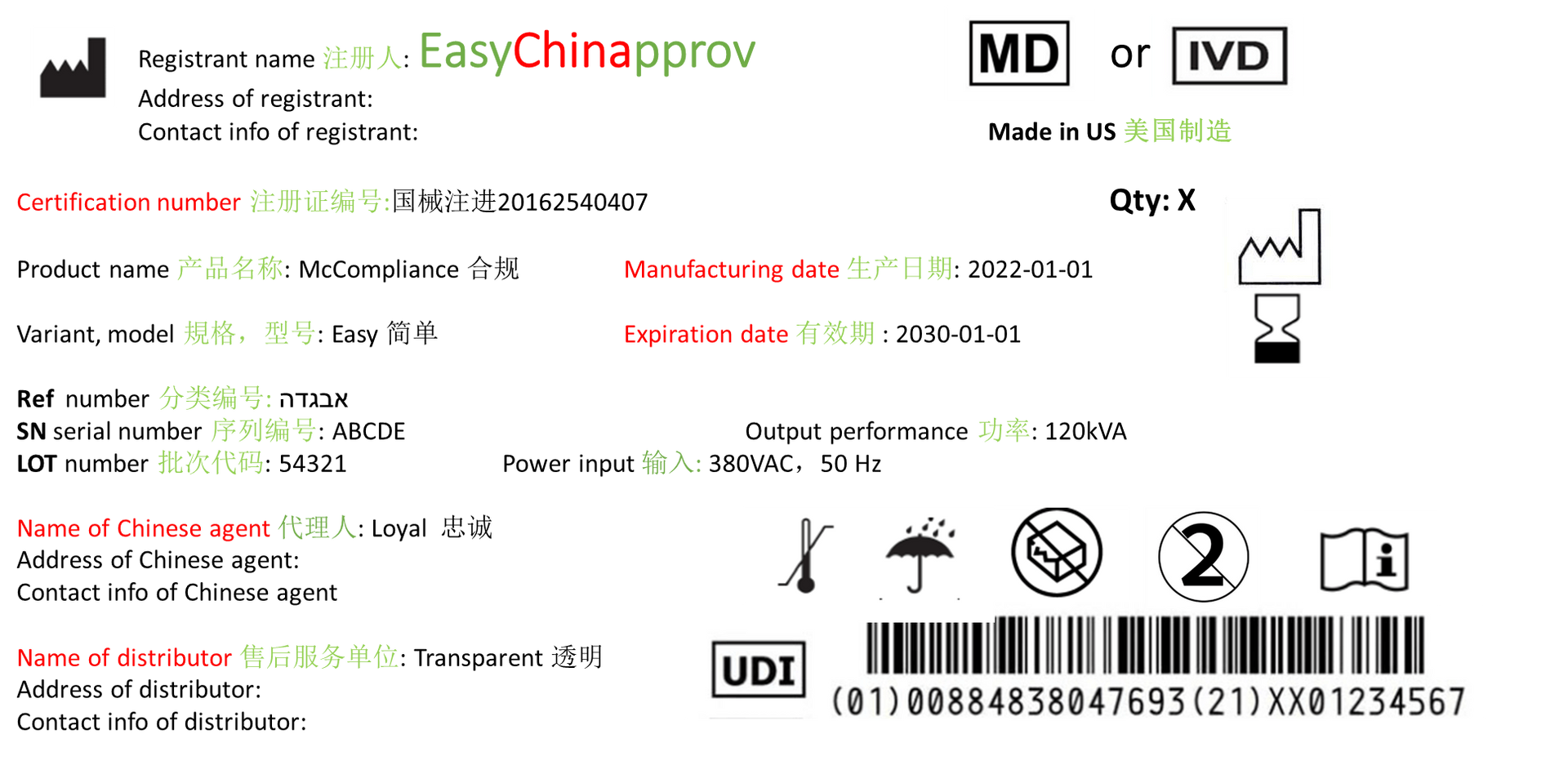
Étiquetage chinois
Pour et après l'enregistrement, vous avez besoin d'un étiquetage chinois, comme mode d'emploi et étiquette. En Chine, il est réglementé par des directives et des normes qui sont essentielles sur les instructions d'utilisation et l'étiquette comme numéro d'enregistrement, terme de symbole, etc.
voir exemple suivant
Événement indésirable grave
Ce qui suit fait partie du formulaire d'événement indésirable que le fabricant doit remplir.
L'événement indésirable grave est défini comme le dommage que l'une des situations suivantes est rencontrée :
1. Danger de mort ;
2. Causer des dommages permanents à la fonction corporelle ou des blessures à la structure corporelle ;
3. Des mesures médicales sont nécessaires pour éviter les dommages et blessures permanents mentionnés ci-dessus.
voir notre modèle

Apprentissage en ligne
Essayez de bénéficier de notre modèle, elearning (en expansion, voir un court exemple ci-dessous dans youtbe.), blog. Nous essayons de générer une science des affaires réglementaires pour expliquer non seulement la réglementation chinoise dans un langage global.
Une autre option pour être à jour avec la réglementation chinoise et être efficace lors de l'enregistrement chinois est de réserver notre formation personnelle en fonction de votre demande, seul ou en groupe. Apportez vos questions, études de cas, nous enseignons les points forts des compétences d'inscription, de projet et de communication et donnons des suggestions pour vos questions.




