Typprüfung von Medizinprodukten in China
TYPISCH CHINESISCH und ANSPRUCHSVOLLE Typprüfung
Typprüfungen sind ein einzigartiges chinesisches Phänomen und werden auch als In-Country-Tests oder Produkt-/Probentests bezeichnet. Ähnliche Tests gibt es auch in Russland und Brasilien (ANATEL).
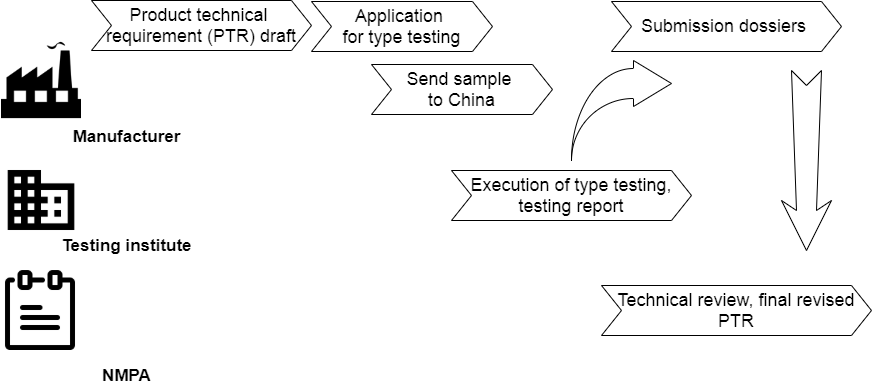
Neben der Erstellung der Einreichungsdossiers in Papierform bei der Produktregistrierung muss das ausländische Medizinprodukt nach der Erstellung der technischen Produktanforderungen (PTR) wie in Abbildung 1 dargestellt an von der NMPA in China akkreditierte Prüfinstitute gesendet werden. Die Typprüfung gilt für Medizinprodukte der Klassen II und III. Der abschließende Prüfbericht ist eines der wichtigen Dokumente unter den Einreichungsdossiers. Das überarbeitete PTR mit Funktionsspezifikationen wird von der Behörde geprüft und nach der Produktzulassung als Anhang mit Stempel zusammen mit dem NMPA-Zertifikat ausgestellt.
Der Biokompatibilitätsbericht, die vorklinische Studie, der Bericht zur Haltbarkeitsvalidierung und der Verpackungsvalidierung gehen über die Typprüfung hinaus und diese Berichte werden häufig von der NMPA akzeptiert.
Der Arbeitsablauf der Typprüfung zeigt einen wirklich langen Prozess, der ein Drittel des Zeit- und Arbeitsaufwands der gesamten Produktregistrierung in Anspruch nehmen kann. Der Input für die Typprüfung wird von den zugelassenen Herstellern als PTR erstellt. Nach Bestätigung durch das Prüfinstitut kann das Medizinprodukt nach China versendet werden. Normalerweise ist es besser, einen erfahrenen Ingenieur und einen Chinesisch sprechenden Experten zu wählen, der den Test begleitet. Sie können medizinische Geräte bedienen und direkt bei der Prüfung Fragen beantworten. Parallel dazu kann der Hersteller, indem er auf den Testbericht wartet, mit der Vorbereitung des Haupteinreichungsdossiers beginnen. Bei der technischen Überprüfung durch die NMPA werden auch der Testbericht und die überarbeitete PTR geprüft.
Wenn Sie die Typprüfung erfolgreich abschließen, scheinen Sie den schwierigsten Teil des „Marathons“ der Produktregistrierung in China geschafft zu haben!
Neu
Ab 2021 werden Typprüfungen und Prüfberichte von qualifizierten eigenen oder externen Prüfinstituten von der NMPA akzeptiert
Vorgehensweise, Zeit, Kosten und Unterlagen für die Typprüfung
1. Vorgehensweise
In Abbildung 2 sind die wichtigen Schritte bei der Typprüfung dargestellt. Ansprechpartner sind überwiegend Prüfingenieure der Prüfinstitute. Auch während der technischen Prüfung durch die NMPA tauschte sich der Prüfer mit den Prüfingenieuren über die Prüfdetails aus. Nach der Anwendung der Typprüfung wird der PTR-Entwurf von Prüfinstituten bewertet, bevor legale Hersteller eine Vereinbarung mit ihnen unterzeichnen.
Ein ausländischer Hersteller kann die Probe dann zum Testen vorbereiten, in China importieren und sogar vorab testen, indem er ein schwieriges Testszenario im Heimatland simuliert. Aufgrund der hohen Testnachfrage kommt es normalerweise zu langen Wartezeiten bis zum genauen Termin der Typprüfung.
2 mal
Wartezeit in der Warteschlange vor der Typprüfung
Nach Durchführung der Typprüfung: 3-6 Monate je nach Prüfinstitut.
Nicht alle Medizinprodukte fallen in den Leistungsbereich der Prüfinstitute. In diesem Fall sollte der Hersteller bei der zentralen NMPA die Genehmigung dieses Tests bei einem Testinstitut beantragen, bei dem die Beantragung etwa einen Monat dauert.
Dauer der Typprüfung: 3-6 Monate je nach Produkttyp
* Die Zeit könnte im Einzelfall länger sein. Es gibt unvorhergesehene Fehlerbehebungen vor Ort beim Hersteller. Es gibt immer Warteschlangen mit unterschiedlichen Testeinheiten, die aufeinander folgen müssen, anstatt parallel zu testen.
Im Durchschnitt ist das Testen eigenständiger Software und passiver MD weniger zeitaufwändig als das Testen elektrischer medizinischer Geräte. Zuletzt müssen die Sicherheits- und elektromagnetischen Verträglichkeitsprüfungen vor Ort in verschiedenen Prüfeinheiten durchgeführt werden.
3. Kosten
Die Kosten für Typprüfvarianten liegen je nach Produkttyp und Prüfinstitut zwischen 5.000 und 20.000 EUR.
4. Dokumente
- PTR-Gebrauchsanweisung (Chinesisch)Etiketten (Chinesisch)
Aktives elektrisches Medizingerät:
- IEC 60601-1- und IEC 60601-1-2-Bericht, Zertifikate kritischer Komponenten, EMV-Inhalte (Produktkomponenten, Stromversorgungskabel, Liste kritischer Komponenten, unterstützendes Zubehör für Tests), elektrischer Schaltplan, Schaltpläne
Einige Probleme, Gedanken und sogar Illusionen zum Thema Typprüfung
Es ist nicht ganz nachvollziehbar, welche wesentlichen Leistungsspezifikationen für die Typprüfung wesentlich sind, wenn keine produktspezifischen Leitlinien oder Normen vorliegen. Auch ist es offensichtlich ungleich, auf welche Kernbereiche sich die einzelnen Prüfinstitute spezialisiert haben. Dies führt zu einer „unzumutbaren“ Fehlerbehebung während der Typprüfung. Finden Sie zuverlässige Beratungspartner mit Erfahrung in interessierten Produktgruppen und besser noch mit einem starken Netzwerk zu Prüfinstituten.
Derzeit ist sich die NMPA der unvermeidbaren Nachteile der Typprüfung bewusst. Sie versuchen, die Richtlinie zu lockern, um qualifizierteren externen Testinstituten das Eingreifen zu ermöglichen und in neuen Benachrichtigungen Selbstberichte über Tests zu akzeptieren. Hoffentlich wird die Typenprüfung eines Tages in ihrem Umfang eingeschränkt oder abgeschafft, indem die meisten oder alle ausländischen Prüfberichte von akkreditierten Prüflabors akzeptiert werden. Es wird spekuliert, dass der Testbericht chinesischer Hersteller für medizinische Geräte gleichzeitig auch von der weltweiten Behörde akzeptiert wird.
PTR und Typprüfung sind typisch „made in China“. Für ausländische Hersteller ist diese Prüfung eine absolute Entschleunigung bei der Produktregistrierung in China. Zweifellos handelt es sich hauptsächlich um eine wiederholte Prüfung oder sogar Prüfung, die durch interne Verifizierungstests und andere Tests durch externe Prüflabore aus Sicht ausländischer Hersteller abgedeckt wird. Allerdings gibt es tatsächlich einige Unterschiede zwischen chinesischen und internationalen Standards, die zusätzliche Anforderungen stellen.
Beachten Sie, dass die Behörde im chinesischen Lebenszyklus in der Lieferkette jedes Jahr die zu prüfenden Produkte und anwendbaren Prüfgegenstände auf chinesische Standards konzentriert.