Haltbarkeitstest in China
auch Accelerated Shelf-Life – (ASLT), Haltbarkeits- oder Stabilitätstest genannt

Definition der Haltbarkeit von Medizinprodukten in China
Was steht in der chinesischen Anleitung?
Die Haltbarkeit aktiver Medizinprodukte bezieht sich auf den voraussichtlichen Zeitraum, in dem der Antragsteller für die Registrierung eines Medizinprodukts die sichere und wirksame Verwendung des Produkts durch Risikomanagement vor der Markteinführung gewährleisten kann und in dem das Produkt seinen Anwendungsbereich beibehalten kann.
Die Haltbarkeit passiver implantierbarer medizinischer Geräte bezieht sich auf den Zeitraum, in dem medizinische Geräte in Form von Endprodukten gelagert werden und ihre vorgesehene Funktion erfüllen können. Das Ende der Haltbarkeitsdauer ist das Verfallsdatum des Produkts. Nach diesem Zeitraum kann es sein, dass das Medizinprodukt nicht mehr die erwarteten Leistungsparameter und Funktionen aufweist.
Die Haltbarkeitsdauer (oder auch Stabilität oder Alterung genannt) ist ein üblicher Begriff, den die Hersteller auf der Etikettierung angeben (gültiger Zeitraum oder als Verfallsdatum). Die Haltbarkeitsdauer von x Jahren wird häufig aus der besten Praxis auf diesem Gebiet, aus der Analyse kritischer Komponenten und möglicherweise aus der Haltbarkeitsdauer von Konkurrenzprodukten abgeleitet. Die FDA fordert eine beschleunigte Prüfung der Haltbarkeitsdauer entsprechender Medizinprodukte. In der EU gibt es trotz der Erwähnung des Begriffs in der MDR keine besonderen Richtlinien zur Haltbarkeitsdauer. Kürzlich hat die chinesische Behörde NMPA die Haltbarkeitsvalidierung von Medizinprodukten durch verbindliche Vorschriften und den Schwerpunkt auf Haltbarkeitsnachweisen im Prüfzeitraum weiterer Medizinprodukte gestärkt.
Darüber hinaus ist in der „Gebrauchsanweisung und Kennzeichnung“ festgelegt:
DIE WOLKE
Artikel 10 (10): Herstellungsdatum, Haltbarkeitsdauer oder Verfallsdatum
Etikett
Artikel 13 (5): Herstellungsdatum, Haltbarkeitsdauer oder Verfallsdatum
In der Norm YY/T 0466.1-2016 „Symbole – Teil 1 Medizinprodukte für Etiketten, Kennzeichnung und Informationen von Medizinprodukten: Allgemeine Anforderungen“ ist ein Symbol für das Herstellungsdatum und die Haltbarkeitsdauer erforderlich, das mit der Gültigkeit des Medizinprodukts identisch ist.
Regulierung der Haltbarkeit in China
Die folgenden Leitlinien und Standards sollten bei der Erstellung des Einreichungsdossiers beachtet werden. Bisher gibt es Leitlinien für aktive und passive implantierbare medizinische Geräte. In chinesischen Standards sind auch Anforderungen an die Haltbarkeit steriler Medizinprodukte verbindlich.
Standards
GB/T 34986-2017 „Methoden für produktbeschleunigte Tests“
YY/T 0681.1-2018 „Testmethoden für sterile Verpackungen medizinischer Geräte, Teil 1: Leitfaden für beschleunigte Alterungstests“
Orientierungshilfe
„Haltbarkeitsdauer des aktiven Medizinprodukts“
„Haltbarkeit passiver implantierbarer medizinischer Geräte“ (Entwurf 2021)
Aktives medizinisches Gerät
Es gibt einige Wege zur Validierung der Haltbarkeitsdauer im Leitfaden „aktive Haltbarkeitsdauer von Medizinprodukten“. Die erste Option besteht darin, eine Analyse kritischer Komponenten (oder funktionsbezogener, austauschbarer, beweglicher Komponenten) durchzuführen. Die zweite Option besteht in Echtzeit- oder Beschleunigungstests. Beschleunigte Tests sind für die Markteinführung oft unbedingt zulässig, müssen jedoch durch Echtzeitdaten nachverfolgt werden.
Für den Ablauf der Haltbarkeitsanalyse sollten die folgenden Einflussfaktoren berücksichtigt und genutzt werden:
- Kritische KomponentenHäufigkeit und Intensität der NutzungTransport, Lagerung und NutzungsumgebungReinigung und DesinfektionVerpackung und SterilisationWartung und Reparatur von KomponentenKommerzielle Faktoren
Vorlage für einen Bericht zur Haltbarkeitsanalyse
- Ziel (Informationen zum Medizinprodukt)BewertungsmethodeBewertungspfadAnalyse der Einflussfaktoren Übersicht über die Bewertung
| Artikel | Kommentare |
|---|---|
| Name des Produkts (Systems)/Subsystems/Komponenten | - |
| Beeinflussende Faktoren | - |
| Modell | - |
| Attribute | Unabhängig entwickelte/gekaufte Teile |
| Beziehungstypen aufschlüsseln | Kritische Teile/unkritische Teile; charakteristische Teile/nicht charakteristische Teile; austauschbare Teile/nicht austauschbare Teile; bewegliche Teile/nicht bewegliche Teile; elektronische Teile/mechanische Teile |
| Attribute | - |
| Lebensdauer / Ausfallrate | Unabhängig entwickelte/gekaufte Teile |
| Bewertungsmethode | Beschleunigter/Echtzeit-Alterungstest; Empirische Daten; Zuverlässigkeitsanalysemethoden, Simulationstestmethoden oder andere Theorien und Simulationsrechnungen; |
| Evaluierung der abgeschlossenen Einheit | - |
| Ob es während der Nutzungsdauer zu unzumutbaren Risiken führt | - |
- FazitAnhang
(1) Testbericht zur beschleunigten Alterung
(2) Ermüdungstestbericht
(3) Simulationsberechnungsbericht
(4) Zuverlässigkeitsanalysebericht
(5) Bericht zur empirischen Datenanalogieanalyse
(6) Risikoanalysebericht
Haltbarkeitsprüfung in Echtzeit
Eine andere Möglichkeit besteht darin, einige medizinische Geräte nach x-jähriger Nutzung wieder aus dem Feld zu nehmen. Die wichtigsten Sicherheits- und Leistungstests sollten durchgeführt werden, um die Sicherheits- und Wirksamkeitsanforderungen nachzuweisen. Unverzichtbar als Einreichungsunterlagen bei der Behörde sind ein Testplan und ein Testbericht, besser noch, wenn alle Tests bestanden wurden:)
Je länger das Gerät für Echtzeittests aus dem Feld genommen wird, desto überzeugender ist das Ergebnis des Validierungstests. Im Idealfall sollten x Jahre auf dem Feld länger sein oder mindestens dem definierten Haltbarkeitsjahr entsprechen.
Beschleunigung der Haltbarkeitsprüfung
Die beschleunigte Validierung der Haltbarkeitsdauer basiert auf der Arrhenius-Formel (ASTM F1980), um die Verfallsrate des Produkts zu beschleunigen, ohne die Mechanismen oder die Reihenfolge der unter normalen Lagerungsbedingungen im Produkt beobachteten Veränderungen zu ändern. Die Arrhenius-Gleichung besagt, dass ein Temperaturanstieg von 10 °C die Geschwindigkeit einer Reaktion verdoppelt. Der Hersteller muss je nach Medizinprodukt einen variablen Faktor für die Beschleunigungszeit und die Beschleunigungstemperatur wählen, um einen Plan zur Beschleunigung der Haltbarkeitsprüfung zu erstellen.
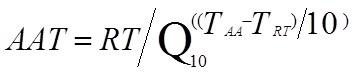
AAT: Beschleunigungszeit
RT: tatsächliche Haltbarkeitsdauer
F10: Beschleunigungsfaktor
TAA: Beschleunigungstemperatur
TRT: Echte Lagertemperatur
Passives implantierbares medizinisches Gerät
Im Jahr 2021 veröffentlichte die NMPA einen Richtlinienentwurf zur „Haltbarkeit passiver implantierbarer medizinischer Geräte“, der für passive implantierbare medizinische Geräte gilt.
Ebenso wie bei aktiven medizinischen Geräten sollten Einflussfaktoren auf die Haltbarkeit passiver implantierbarer medizinischer Geräte berücksichtigt werden:
Innerer Impact-Faktor
- Kritische Komponenten und MaterialienInteraktion zwischen Komponenten und MaterialInteraktion zwischen Komponenten/Material und VerpackungsmaterialHerstellungsprozess (wie Sterilisation)Radioaktives MaterialMikrobielle Barriere
Äußerer Einflussfaktor
- LagerbedingungenTransportbedingungenHerstellungsmethodeHerstellungsumgebungVerpackungRohmaterial
Es gibt zwei Möglichkeiten zur Validierung der Haltbarkeit passiver implantierbarer medizinischer Geräte: Haltbarkeitstests in Echtzeit und beschleunigte Haltbarkeitstests. Das Prinzip ist oben im Kapitel „Aktive medizinische Geräte“ beschrieben.
Für beide Validierungen sollten der Leistungstest (physikalische, chemische und ggf. Biokompatibilität) und die Verpackungsvalidierung nach der Haltbarkeitsprüfung erfolgen. Dies bedeutet, dass innerhalb der Haltbarkeitsdauer des Medizinprodukts die Hauptleistung und die intakte Verpackung gewährleistet sind. Es wird empfohlen, drei Prüfpunkte zur Durchführung von Leistungs- und Verpackungstests einzurichten. Daher sollte der letzte Kontrollpunkt mit der vorgeschlagenen Haltbarkeitsdauer übereinstimmen.
Fazit aus Best Practice
Es gibt keine feste Regel, wann welcher Weg zum Nachweis der Haltbarkeit bei der Registrierung von Medizinprodukten in China verwendet werden soll. Wir möchten auf das häufige Szenario von Haltbarkeitsnachweisen aus der jüngsten Produktregistrierung hinweisen.
Es ist üblich, dass bei der Erstregistrierung eine beschleunigte Haltbarkeitsprüfung nicht vermieden werden kann. Bei der Änderungsregistrierung besteht die beste Möglichkeit darin, die Auswirkungen geänderter Artikel auf die Haltbarkeitsdauer des betreffenden Medizinprodukts zu analysieren, kombiniert mit einer Echtzeitprüfung des Medizinprodukts vor Ort. Ähnlich wie bei der Erneuerung reicht oft eine Echtzeitprüfung des Medizinprodukts aus.
Ein Tauziehen um die Haltbarkeit scheint in China zum Standardprogramm bei der Registrierung von Medizinprodukten zu gehören.