Klinische Bewertung und klinische Studie in China
Chinesische klinische Bewertung
Nur ein wenig anders mit einigen chinesischen Anforderungen
Klinische Bewertung und klinische Studie sind ein wesentlicher Bestandteil des Einreichungsdossiers bei der Registrierung von Medizinprodukten bei der NMPA in China. Das Prinzip der klinischen Studie besteht darin, den bestimmungsgemäßen Einsatz eines Medizinprodukts zu ermöglichen, das Produktrisiko aufgrund des überwiegenden Nutzens zu akzeptieren und die Konformität der Sicherheits- und Wirksamkeitsanforderungen nachzuweisen.
Die Philosophie der klinischen Bewertung in China basiert auf einer weitgehenden Gleichwertigkeit bei der FDA, obwohl in den USA keine klinische Bewertung erforderlich ist. Die Regulierung der chinesischen CER (neu im Jahr 2021) entspricht bis auf die Post-Market-Details fast der europäischen Regulierung. Das betreffende Gerät wird mit gleichwertigen oder ähnlichen Geräten verglichen, die normalerweise dieselbe Produktgruppe (chinesischer Produktcode), einen ähnlichen Verwendungszweck und ähnliche technische Eigenschaften aufweisen.
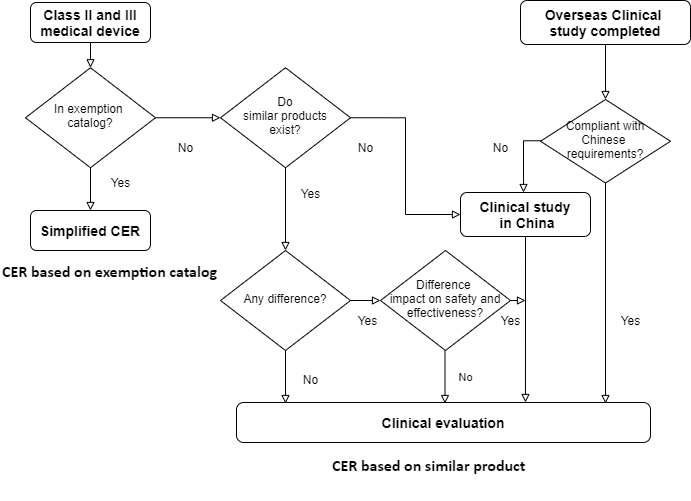
Es gibt vier Alternativen der klinischen Bewertung, um die Konformität der Sicherheits- und Wirksamkeitsanforderungen von Medizinprodukten in China nachzuweisen:
- CER basierend auf AusnahmekatalogCER basierend auf gleichwertigen oder ähnlichen GerätenCER mit akzeptierter klinischer Studie im AuslandKlinische Studie in China
Wir würden die Anforderungen der klinischen Bewertung von Medizinprodukten der Klassen II und III in China bewerten.
Im realen Projekt stellen wir eine detaillierte Vorlage für die klinische Bewertung zur Verfügung.
1. CER basierend auf Ausnahmekatalog
Wenn sich das Produkt im „Katalog von Medizinprodukten, die von klinischen Studien ausgenommen sind“ befindet, müssen die Hersteller das betreffende Produkt mit der Beschreibung im Katalog und mit Elementen wie beabsichtigter Verwendung, Zusammensetzung, Wirkungsmechanismus, Herstellungsmaterialien, Funktionsspezifikationen, Sterilisation/Desinfektion und Betriebsmethode gleichwertiger Geräte vergleichen, die in China getestet wurden. Dies ist Hauptbestandteil des vereinfachten Ausnahmekatalogs für die klinische Bewertung.
Eine auf dem Ausnahmekatalog basierende CER ist ausgeschlossen, wenn das betreffende Medizinprodukt im Vergleich zu einem ähnlichen Medizinprodukt Folgendes aufweist:
- Neues Material, neue Technologie, neues Design, neue Wirkstoffe, neuer Wirkmechanismus, Änderung oder Erweiterung des Verwendungszwecks, Leistungsspezifikationen entsprechen nicht den chinesischen Standards
Aktualisierung des „Katalogs der von klinischen Prüfungen ausgenommenen Medizinprodukte“
Bisher (Okt. 2021) sind 1010 Produktcodes im „Katalog der von klinischen Studien ausgenommenen Medizinprodukte“ aufgeführt. Für das entsprechende Medizinprodukt benötigen Hersteller lediglich eine vereinfachte CER.
2. CER basierend auf gleichwertigen oder ähnlichen Geräten
Wenn das Produkt nicht im Katalog enthalten ist, es jedoch in China zugelassene gleichwertige Geräte (entweder eigene frühere medizinische Geräte oder medizinische Geräte anderer Hersteller) gibt, ist eine angemessene klinische Bewertung im Vergleich zu gleichwertigen Geräten erforderlich.
Der Umfang dieser Art der klinischen Bewertung sollte den neuen Leitlinien „Klinische Bewertung von Medizinprodukten, Nr. 73, 2021“ / Klinische Bewertung von IVD, Nr. 74, 2021 entsprechen und ist den Anforderungen der MDR 2017/745 (Anhang XIV und XV) und der Revision 4 der MEDDEV 2.7/1 bei MDD in Europa ziemlich ähnlich.
Vorlage für chinesische CER
Wir stellen die Hauptkapitel (Neu im Jahr 2021) der chinesischen klinischen Bewertung vor:
- Produktbeschreibung und F&E-HintergrundUmfang der klinischen BewertungKlinischer BewertungspfadAnalysieren und bewerten Sie die klinischen Daten mit gleichwertigen Geräten
A. Führen Sie eine klinische Bewertung anhand klinischer Daten gleichwertiger Geräte durch
- ÄquivalenzbewertungZusammenfassung und Auswertung klinischer Daten gleichwertiger GeräteAnalyse klinischer Daten gleichwertiger Geräte
B. Analysieren und bewerten Sie anhand klinischer Studiendaten
5. Schlussfolgerung
6. Persönliche klinische Bewertung
Definition
Klinische Daten sind Informationen zur Sicherheit oder Leistung, die durch die Verwendung eines Geräts generiert werden.
Klinische Daten = präklinische Studie klinische Literatur klinische Studie unerwünschte Ereignisse Korrekturmaßnahmen usw.
Gleichwertige Geräte
Um äquivalente Geräte zu ermitteln, sollten die folgenden Punkte zwischen Fach- und äquivalenten Geräten verglichen werden.
Wie in Abbildung 3 zu sehen ist, sind Anwendungsbereich, technische und biologische Eigenschaften Hauptkriterien für die Auswahl gleichwertiger Geräte bei der klinischen Bewertung in China. Es ist fast dasselbe wie bei Clinical Evaluation – Equivalence (MDCG 2020-5), bei dem der Anwendungsbereich als klinische Merkmale bezeichnet wird.
Gleichwertige Geräte ≠ ähnliche Geräte
In den neuen Leitlinien wird eine Definition ähnlicher Geräte eingeführt. Es kann Unterschiede zwischen dem Thema und den verglichenen Geräten geben. Der Unterschied wird anhand von drei Kategorien in Abbildung 3 analysiert. In diesem Fall kann das unterstützende Material Labortests (vorklinische Tests) und Daten aus klinischen Studien sein. Wenn die Begleitmaterialien Labortests umfassen, sollten der Testplan und der Testbericht als Anlagen eingereicht werden.
3.CER mit anerkannter klinischer Studie im Ausland
Können ausländische klinische Studien oder medizinische Studien von den chinesischen Behörden akzeptiert werden? Unter chinesischen Verhältnissen lautet die Antwort eindeutig „Ja“. Wir helfen Ihnen bei der Analyse des Leitfadens „Zulassung ausländischer klinischer Studiendaten von Medizinprodukten“ aus dem Jahr 2018. Voraussetzung ist eine klinische Studie im Ausland gemäß ISO 14155 in guter klinischer Praxis. Die ausländischen Hersteller müssen mindestens einen klinischen Studienplan, eine ethische Stellungnahme und ein klinisches Studienprotokoll vorlegen.
Die folgenden Faktoren müssen bei der Annahme einer klinischen Studie im Ausland berücksichtigt werden:
- Endpunkt der klinischen StudieAbweichung der Bevölkerung (asiatische Ethnie)Studienbedingungen sind von wesentlicher Bedeutung
Der Hersteller könnte rational erklären, warum asiatische Ethnien nicht für das betreffende Projekt gelten, und zu dem Schluss kommen, dass keine zusätzliche klinische Studie in China erforderlich ist.
Es besteht ein guter Trend, dass die NMPA versucht, immer mehr klinische Studien im Ausland zu akzeptieren und sich gleichzeitig an den internationalen Vorschriften für Medizinprodukte zu orientieren. Es wird empfohlen, die klinischen Anforderungen in China zu prüfen, bevor mit einer klinischen Studie im Ausland und sogar mit einer Post-Market Clinical Follow-up-Studie (PMCF) (EU) begonnen wird. Es lohnt sich, die klinischen Anforderungen Chinas in einer multizentrischen klinischen Studie zu berücksichtigen.
4. Klinische Studie in China
Das komplexeste und kostenintensivste Szenario besteht darin, dass ausländische Hersteller klinische Studien in China durchführen müssen. Sie gilt für einige Medizinprodukte der Klasse III, die von der Behörde als Hochrisikoprodukte eingestuft werden, obwohl die klinische Studie im Ausland akzeptiert werden könnte. Die klinische Studie ist am wahrscheinlichsten für innovative Produkte ohne in China zugelassene ähnliche Produkte. Normalerweise sind für klinische Studien in China mindestens zwei klinische Forschungsorganisationen erforderlich.
Neue Leitlinien für gute klinische Praxis in China (2022)
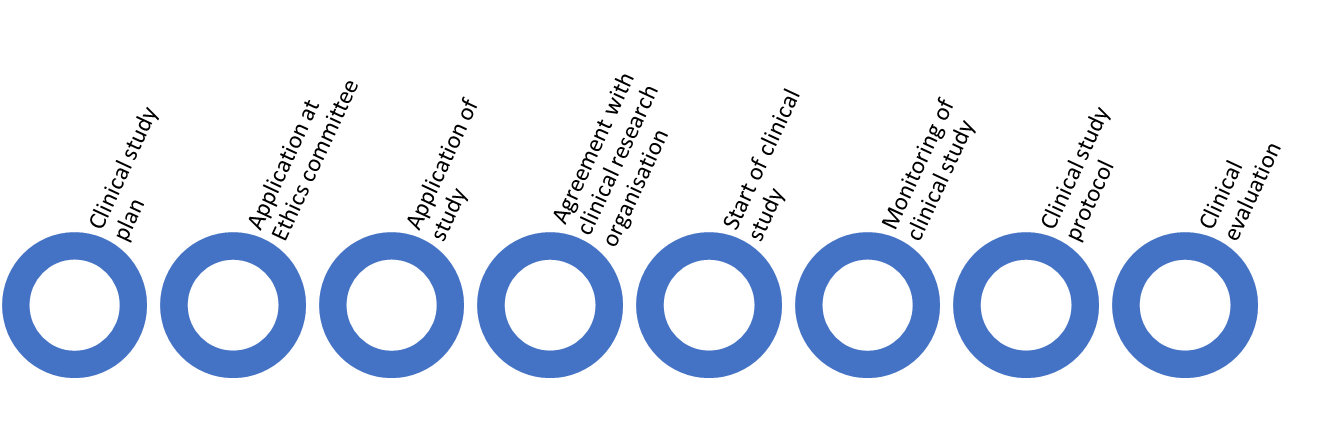
Dies ist ein grober Ablauf klinischer Studien in China. Die Eingabe ist ein klinischer Studienplan. Der erste Antrag erfolgt bei der Ethikkommission. Anschließend erfolgt die Beantragung einer klinischen Studie bei der Behörde. Wenn innerhalb von 60 Arbeitstagen keine Rückmeldung von der Behörde erfolgt, kann der Hersteller die klinische Studie im Krankenhaus durchführen. Am Ende wird das Studienprotokoll wie oben erläutert in die klinische Bewertung integriert.
Vor der Beantragung einer klinischen Studie sind folgende Unterlagen bei der Ethikkommission einzureichen:
- Klinischer StudienplanForscherhandbuchEinverständniserklärungVerfahrensdokumente für die Rekrutierung und Beförderung von ProbandenFallberichtsformularSelbstinspektionsbericht und TypprüfungsberichtLebenslauf des Forschers, berufliches Fachwissen, Fähigkeit, Ausbildung und andere Dokumente zum Nachweis seiner QualifikationEinrichtungen und Bedingungen der Organisation klinischer StudienEine Erklärung, dass die Entwicklung des zu testenden Medizinprodukts den relevanten Anforderungen des geltenden Qualitätsmanagementsystems für Medizinprodukte entspricht
Anschließend erfolgt eine Bewerbung für eine klinische Studie mit folgenden Unterlagen:
- Antragsformular Herkunftsland-Genehmigungszertifikat, ISO 13485-Zertifikat, kostenloses VerkaufszertifikatGerätebeschreibungForschungsinformationen: präklinische Tests, Bericht über unerwünschte Ereignisse, klinischer Nutzen-Risiko-BerichtTechnische ProduktanforderungenTypenprüfungGebrauchsanweisung und EtikettKlinischer StudienplanVereinbarung mit der Ethikkommission
Die offiziellen Kosten für die Bewerbung für eine klinische Studie betragen 5,3.000 Euro und die technische Prüfung dauert etwa 60 Arbeitstage.
Ausblick auf die klinische Bewertung in China (2021)
45 % aller Medizinproduktegruppen sind von der klinischen Bewertung ausgenommen. 42,5 % der Medizinprodukte benötigen eine klinische Bewertung, während nur 12,5 % der gesamten Medizinprodukte einer klinischen Prüfung unterzogen werden müssen.
CER-Pfade für 7 Produktgruppen von chinesischer Behörde erläutert
Im Mai 2022 veröffentlicht CMDE eine Mitteilung über die Wege der klinischen Bewertung für Produktgruppen. Abhängig von der besten Praxis auf dem Markt macht die chinesische Behörde in den 7 Listen für jeden Produktcode klar, welcher CER-Pfad ausgewählt werden sollte.
Die aufgeführten 7 Produktgruppen:
· 11 Desinfektions- und Sterilisationsgeräte für Medizinprodukte
· 12 aktive implantierbare Geräte
· 13 passive implantierbare Geräte
· 14 Injektions-, Pflege- und Schutzgeräte
· 15 Patientenlagergeräte
· 17 Zahnärztliche Instrumente
· 22 Instrumente für die klinische Untersuchung
In der Liste werden diese Elemente erläutert:
· Produktcode
· Produktbeschreibung
· Verwendungszweck
· Beispiel
· Produkt Klassifikation
· Weg:
1. CER basierend auf Ausnahmekatalog
oder
2. CER basierend auf gleichwertigen oder ähnlichen Geräten
oder
3. oder 4. Klinische Studie im Ausland oder in China
Als Beispiel für 13-xx-xx passive implantierbare Geräte werden in der Liste 18 Produktcodes für eine klinische Studie ausgewählt (Pfad 3 oder 4), 20 Produktcodes basieren auf einer klinischen Bewertung mit einem gleichwertigen Gerät (Pfad 2). und 14 Produktcodes sind von der klinischen Bewertung ausgenommen (Pfad 1). Alle 52 aufgeführten Produktcodes gehören zum Medizinprodukt der Klasse III.
In unserem Blog listen wir in dieser Gruppe alle Produktcodes von Medizinprodukten auf, die für klinische Studien benötigt werden.
E-Learning der chinesischen CER

Service: CER als Service Klinische Studie Lückenanalyse von CER und klinischem Studienplan
Kontaktiere uns .