Registrierungsschritte eines Medizinprodukts in China (Video, Anleitung)
Behörde für die Registrierung von Medizinprodukten in China
Die Chinese Medical Device Evaluation (CMDE) führt die technische Prüfung von Medizinprodukten in China durch. Die neue Gesetzgebung zu Medizinprodukten wird auf der Website von CMDE veröffentlicht, obwohl die übergeordnete Behörde National Medical Products Administration (NMPA) am bekanntesten ist und erwähnt wird.
Leider ist die Website nicht ins Englische übersetzt. CMDE verfügt jedoch über einen eleganten Arbeitsablauf, bei dem die wichtigsten Schritte der Registrierung von Medizinprodukten in China auf Englisch erfolgen. Es eignet sich perfekt für Anfänger und auch für erfahrene RA-Spezialisten, um interessierte Themen hinter dem Arbeitsablauf zu studieren.
Wenn Sie chinesische Originalvorschriften für interessierte „Registrierungsthemen“ herunterladen möchten, müssen Sie mithilfe eines Übersetzungstools zum chinesischen Arbeitsablauf zurückkehren.
Workflow als Überblick
Workflow im Video erklärt
Workflow in detaillierten Skripten
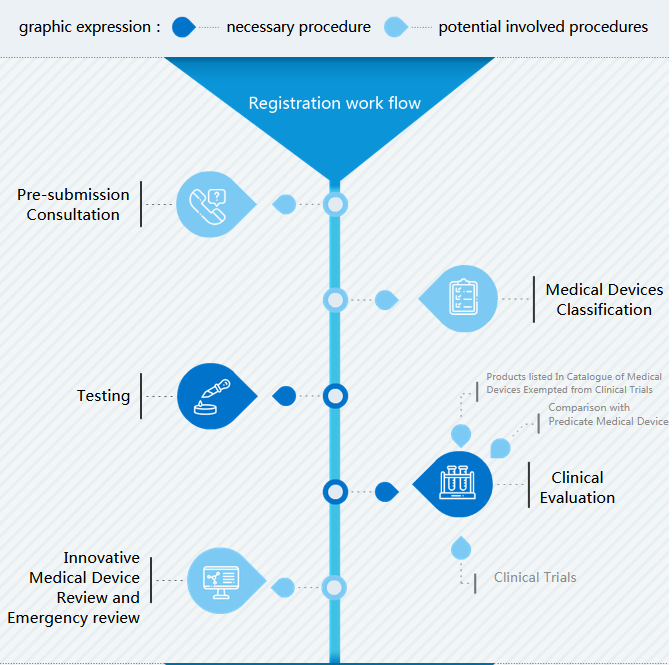
Der Arbeitsablauf bei der Registrierung von Medizinprodukten in China besteht aus drei Teilen:
- Registrierungsarbeitsablauf mit wichtigen SchrittenÜberprüfung und Genehmigung vor Ort der NMPA (vor dem Inverkehrbringen)Registrierungstyp (nach dem Inverkehrbringen)
- I Registrierung: Der wichtige Schritt vor der Erstellung von Einreichungsdossiers ist die Festlegung der Klassifizierung. Bei der Vorbereitung der Registrierung von Medizinprodukten in China sind Typprüfung und klinische Bewertung die anspruchsvollsten Teile.
- II Überprüfung und Genehmigung: Nach der Einreichung technischer Dossiers führt CMDE eine Abnahmeprüfung durch, bei der die Vollständigkeit der Dokumente nachgewiesen wird, sowie eine technische Überprüfung, nach der zusätzliche Informationen angefordert werden.
- III Registrierungsart: Nach der Erstregistrierung ist der Hersteller alle 5 Jahre an der Reihe, das Produktzertifikat zu erneuern. Wenn sich bei einem Medizinprodukt wesentliche Änderungen ergeben, ist eine Änderungsregistrierung erforderlich.
I Registrierung
Klassifizierung von Medizinprodukten
In China gibt es I-, II- und II-Medizinprodukte. Der beste Weg, eine Klassifizierung zu finden, besteht darin, den Produktcode im Klassifizierungskatalog abzugleichen.
Wenn die Klassifizierung nicht ermittelt werden kann, kann der Hersteller das Medizinprodukt direkt als Klasse III registrieren oder die Bestimmung der Klassifizierung bei der NMPA beantragen. Handelt es sich um ein „besonderes“ Medizinprodukt, kann ein innovativer Weg genutzt werden.
(Typ-)Testen
Gegenstand der Typprüfung ist ein Medizinprodukt der Klassen II und III. Der Hersteller muss technische Produktanforderungen entwerfen und ein Testzentrum auswählen.
Nachdem das Medizinprodukt nach China geschickt wurde, werden die Tests durchgeführt.
Klinische Bewertung
In China sind drei Arten der klinischen Bewertung möglich: vereinfachte CER, wenn ein Medizinprodukt im Katalog enthalten ist, das von klinischen Studien ausgenommen ist, CER im Vergleich zu ähnlichen Produkten, die in China zugelassen sind, und klinische Studien in China.
Bewerbungsunterlagen für die Registrierung
Die Einreichungsstruktur hat hier ein neues Inhaltsverzeichnisformat. Die Dokumente in diesem Format sollten über die elektronische regulierte Produktübermittlung (eRPS) eingereicht werden.
Im Arbeitsablauf werden lediglich die Hauptinhalte und Dokumente in den obersten 6 CH-Ordnern angezeigt.
II Prüfung und Genehmigung
Annahme des Registrierungsantrags
Die Akzeptanzprüfung von Einreichungsdossiers ist neu, da es seit 2019 zu einem beginnenden Chaos bei der elektronischen Einreichung von Dossiers über eRPS kommt.
In Unterordnern (auf Ebene CH XX....) sollte der Hersteller ein entsprechendes Dokument einreichen, manchmal sogar eine Erklärung in Dokumenten, wenn der Inhalt nicht für die Themenregistrierung gilt.
Jeder legale Hersteller, der über ein physisches Büro und eine Geschäftslizenz in China verfügt, kann eine Zertifizierungsstelle beantragen, die auf die Nutzung des eRPS-Systems zugreift. Für ausländische Hersteller ohne eigene chinesische Niederlassung übernimmt normalerweise ein chinesischer Vertreter diese Rolle.
Wenn die über eRPS eingereichten Dokumente vollständig sind, stellt CMDE eine „Notice of Acceptance“ und einen „Bill of Payment“ aus. Andernfalls wird ein „Mängelbescheid“ oder ein „Ablehnungsbescheid“ ausgestellt. Beim „Deficiency Letter“ muss der Hersteller die gesamten Dossiers erneut einreichen.
Ergänzend (gleiche technische Überprüfung, ähnlich der inhaltlichen Überprüfung in den USA)
Nach der technischen Prüfung hat der Hersteller ein Jahr Zeit, ergänzende Informationen gemäß „Deficiency Letter“ zu liefern.
Die Zeit der Mängelbeseitigung wird nicht in den Prüfzeitraum eingerechnet. Der Hersteller kann einmal relevante Gutachter konsultieren.
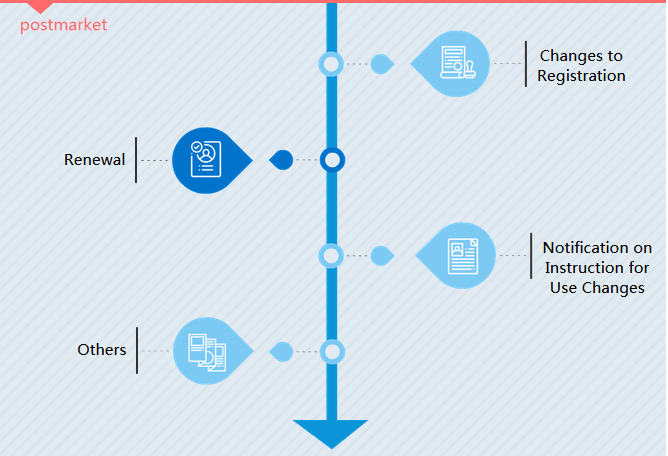
III Registrierungstyp
Änderungen an der Registrierung
Es gibt zwei Arten der Änderungsregistrierung. In der CMDE-Sprache handelt es sich dabei um Änderungen von Berechtigungselementen (Verwaltungsangelegenheit) und Änderungen von Registrierungselementen (wesentliche Änderungsangelegenheit).
In China gibt es kein „Letter to File“ für geringfügige Produktänderungen. Für den internen Prozess und im Falle einer Inspektion durch eine chinesische Inspektion wird jedoch eine Änderungsbewertung empfohlen.
Der Zeitpunkt der technischen Prüfung bei Änderung von Registereinträgen (wesentliche Angelegenheit) durch die Behörde ist derselbe (60 Arbeitstage). Bei Änderungen von Genehmigungsgegenständen (administrative Angelegenheiten) dauert die technische Prüfung nur 20 Arbeitstage.
Bei der Änderungsregistrierung hat ein Medizinprodukt dieselbe Zertifizierungsnummer wie bei der Erstregistrierung. Der Hersteller sollte anschließend die Gebrauchsanweisungen und Etiketten ändern, indem er eine neue ausgestellte Zertifizierungsnummer hinzufügt und das Herstellungsdatum des zugelassenen Medizinprodukts aktualisiert (nach dem Ausstellungsdatum der Zertifizierung).
Erneuerung
Ein Registrierungszertifikat für Medizinprodukte ist in China 5 Jahre lang gültig. Hersteller müssen die Verlängerung spätestens 6 Monate vor Ablaufdatum des Zertifikats beantragen.
Zum Zeitpunkt der Erneuerung sind umfangreiche Anstrengungen bei der Änderungsregistrierung erforderlich, wenn beispielsweise chinesische verbindliche Standards überarbeitet werden. Dies bedeutet häufig neue Anforderungen zum Nachweis der Sicherheit und Wirksamkeit von Medizinprodukten im Hinblick auf neue Typprüfungen, die zunächst eine neue Änderungsregistrierung vor der Erneuerung auslösen.
Video des Registrierungsprozesses
In diesem kurzen Video gibt Ihnen CMDE einen Überblick über die Vorab-Einreichung, die Abnahme sowie die technische Prüfung und Beratung nach einer Mängelrüge in China.