Chinesischer Agent
Ein Schlüsselfaktor für den Erfolg der chinesischen Kommerzialisierung medizinischer Geräte
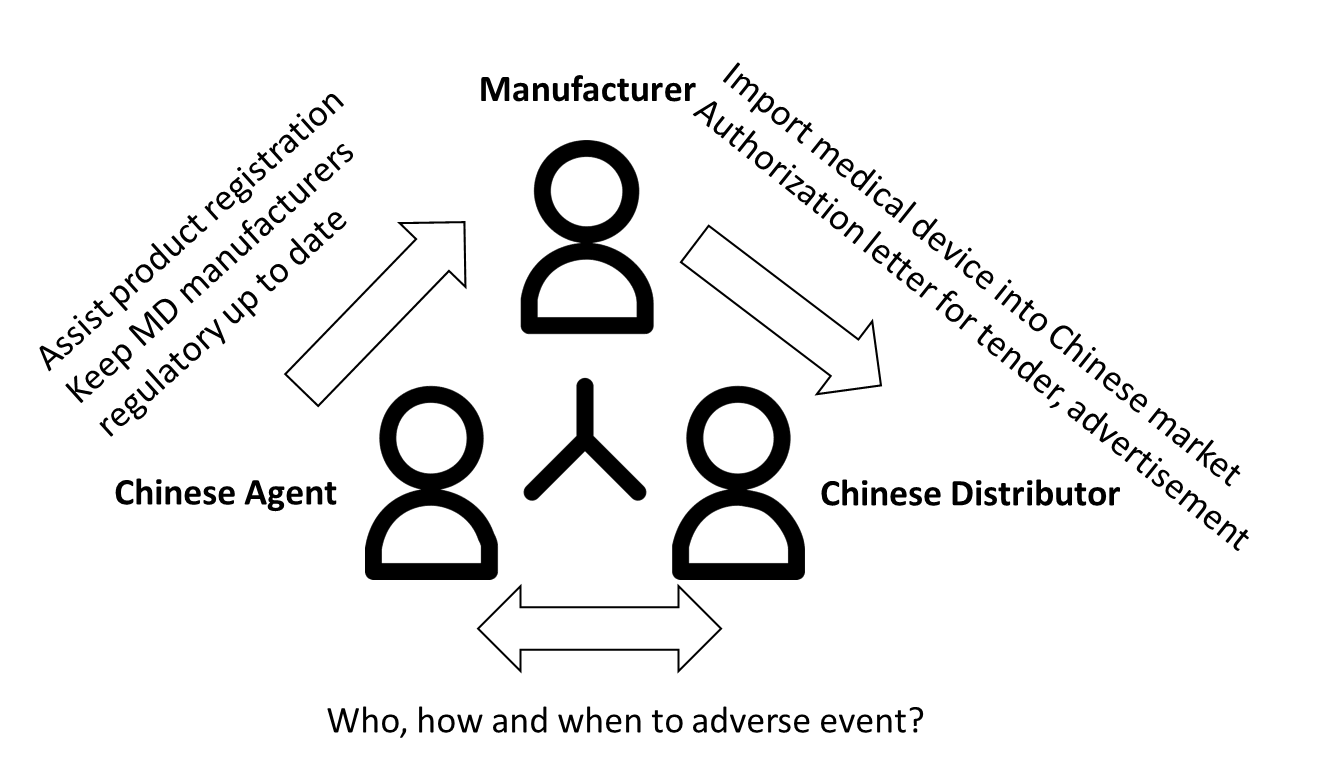
Chinesischer Vertreter für ausländische legale Hersteller in China
Chinesischer Vertreter wird auch als autorisierter Vertreter oder Landesvertreter bezeichnet. Es entspricht einem US-Agenten oder einer verantwortlichen Person im Vereinigten Königreich. Für jeden ausländischen Hersteller, der keine Niederlassung in China hat, ist ein chinesischer Vertreter mit einer Geschäftslizenz in China erforderlich. Ein Hersteller kann beliebig viele chinesische Agenten beauftragen. Es ist jedoch nur ein chinesischer Vertreter pro Produkt erlaubt. Auf dem NMPA-Zertifikat wird neben dem Namen des rechtmäßigen Herstellers auch ein chinesischer Vertreter vermerkt.
Bitte seien Sie nach der erfolgreichen Produktzulassung nicht zu überfordert. Sie haben zu 100 Prozent das Recht, alle von der Behörde ausgestellten endgültigen Zulassungsbescheinigungen (auch „technische Produktanforderung“ als Anhang und Typprüfbericht) anzufordern. Es erleichtert die nächste Änderungs- und Erweiterungsregistrierung als wesentliche Dokumente.
Aufgabe eines chinesischen Agenten
Die regulatorische Verantwortung und die Anforderungen chinesischer Agenten nehmen zu
Verantwortung des chinesischen Agenten:
• Zusammenstellung der Einreichungsdossiers, • Kommunikation mit der NMPA, • Meldung unerwünschter Ereignisse, • Unterstützung bei der möglichen Inspektion durch die Behörde, • Übermittlung der Aktualisierung der Vorschriften
Neu
· Hochladen von UDI-DI und Versicherungscode in die chinesische Datenbank
Schön zu haben
· Bewertung der erheblichen Änderung des zugelassenen Medizinprodukts in China
· Nachweis der Gebrauchsanweisung und Etikett
Umstrittene Verantwortung für die Meldung unerwünschter Ereignisse für ausländische Hersteller
Es ist ein Dilemma, wer unerwünschte Ereignisse bei Post-Market-Aktivitäten aktiv koordinieren sollte. Der chinesische Agent konzentriert sich auf die Registrierung und der Distributor konzentriert sich auf den Verkauf. Mit der neu erlassenen Verordnung stärkte die NMPA indirekt (als autorisierter EU-Vertreter) die Rolle des chinesischen Vertreters für die Meldung unerwünschter Ereignisse und die Aufrechterhaltung des Produktvertriebs.
Den Herstellern ist bekannt, dass sie seit 2019 unerwünschte Ereignisse und Rückrufe melden. Für inländische Hersteller ist es einfacher, wenn die entsprechenden Abteilungen im selben Haus angesiedelt sind. Für ausländische Hersteller liegen die Anforderungen bei der Koordinierung der Meldung unerwünschter Ereignisse und Rückrufe weit zurück. Der chinesische Händler sollte mit dem chinesischen Vertreter eine Vereinbarung darüber treffen, wie er mit der Berichterstattung umgeht und die Verantwortlichkeit regelt. Dies bedeutet, dass ein Verfahren zum Empfangen, Analysieren, Berichten sowie Bearbeiten von AE und Rückrufen erforderlich ist.
Wir empfehlen dringend, diese Rolle dem Vertriebshändler mit Vorsicht zu übertragen. Einerseits verfügen sie nicht über fundierte regulatorische Kenntnisse. In den meisten Fällen beauftragen sie ein anderes Beratungsunternehmen mit der Produktregistrierung. Es besteht eine Ping-Pong-Kommunikation zwischen drei Parteien. Andererseits behalten sie häufig das Original-NMPA-Zertifikat bei, um die nächste Produktregistrierung und sogar den Prozess des Wechsels des chinesischen Vertreters zu blockieren.
Verbindliche Verpflichtung des chinesischen Vertreters
In den Verordnungen zur Überwachung und Verwaltung von Medizinprodukten (Verordnung 2021/739 des Staatsrats) ist Folgendes festgelegt:
Artikel 20
Registranten und Registerinhaber von Medizinprodukten müssen die folgenden Pflichten erfüllen:
(1) Ein Produktqualitätsmanagementsystem einrichten und anpassen und dieses effektiv anwenden;
(2) Entwicklung von Post-Marketing-Studien und Risikomanagementplänen sowie Gewährleistung der wirksamen Umsetzung;
(3) Überwachung und Neubewertung unerwünschter Ereignisse in Übereinstimmung mit dem Gesetz durchführen;
(4) Einrichtung und Umsetzung eines Produktrückverfolgbarkeits- und Rückrufsystems;
(5) Sonstige von der Arzneimittelregulierungsabteilung des Staatsrates festgelegte Verpflichtungen. Die von ausländischen Herstellern benannte inländische juristische Person unterstützt den Registranten und den Anmelder bei der Erfüllung der im vorstehenden Absatz festgelegten Verpflichtungen.
inländische juristische Person = chinesischer Agent
Verwandter Link des Vertreters, des autorisierten Vertreters, der Landesvertretung, der verantwortlichen Person und des Inhabers der Marktzulassung (MAH) oder des Registrierungsinhabers
US-Agenten
Bevollmächtigte EU-Vertreter
Verantwortliche Person im Vereinigten Königreich
Kontaktieren Sie uns, wir sind auch Experten für globale Registrierung.