Ausgelagerte Produktion von zugelassenen oder neuen ausländischen Medizinprodukten in China

Schild
Erstausrüster, Auftragsentwicklungs- und Fertigungsorganisation, Auftragsfertigung, Hersteller von Produktetiketten, Richtlinie für Inhaber von Marktzulassungen
1. Wenn Sie bereits ein Medizinprodukt in China registriert haben, ist dieses weiterhin gültig
Hintergrund
Da die Trennung von Forschung und Entwicklung sowie der Herstellung von Medizinprodukten in zwei unabhängige Parteien für lokale Interessengruppen im Jahr 2018 in China ein Trend ist, wurden im Jahr 2020 in einer Mitteilung „Importierte Medizinprodukteprodukte werden von Unternehmen in China hergestellt“ (Nr. 104) zunächst die Anforderungen für die Herstellung zugelassener ausländischer Medizinprodukte festgelegt.
Voraussetzung für die Herstellung ausländischer Medizinprodukte:
· Es gilt nur für in China bereits zugelassene Medizinprodukte der Klassen II und III, die ursprünglich im Ausland hergestellt wurden.
· Der ausländische Hersteller muss ein ausländisch investiertes Unternehmen in China gründen.
· Der Hauptproduktionsprozess und das Rohmaterial am chinesischen Produktionsstandort sollten im Vergleich zum ursprünglichen im Ausland nicht geändert werden. Es ist ein Vergleichsbericht über die Gleichwertigkeit in- und ausländischer Qualitätsmanagementsysteme vorzulegen.
Die chinesische Behörde hat erwähnt, dass medizinische Geräte von in China ansässigen Unternehmen mit ausländischer Beteiligung hergestellt werden sollten und keine anvertraute oder ausgelagerte Produktion zulässig ist!
Bei der abschließenden Prüfung eines „neu“ in China hergestellten Medizinprodukts, dessen „Übersee-Zwilling“ von der NMPA zugelassen wurde, müssen lediglich Teile früherer Dossiers als technische Dokumentation eingereicht werden. Der Überprüfungsprozess durch die Behörde würde extrem beschleunigt.
In einer weiteren Mitteilung aus dem Jahr 2021 „Leitfaden für die Überprüfung der staatlichen Beschaffung importierter Produkte“ wird die unterstützende Richtlinie dargelegt, dass immer mehr zentrale Beschaffungszentren in China hergestellte Medizinprodukte bevorzugen.
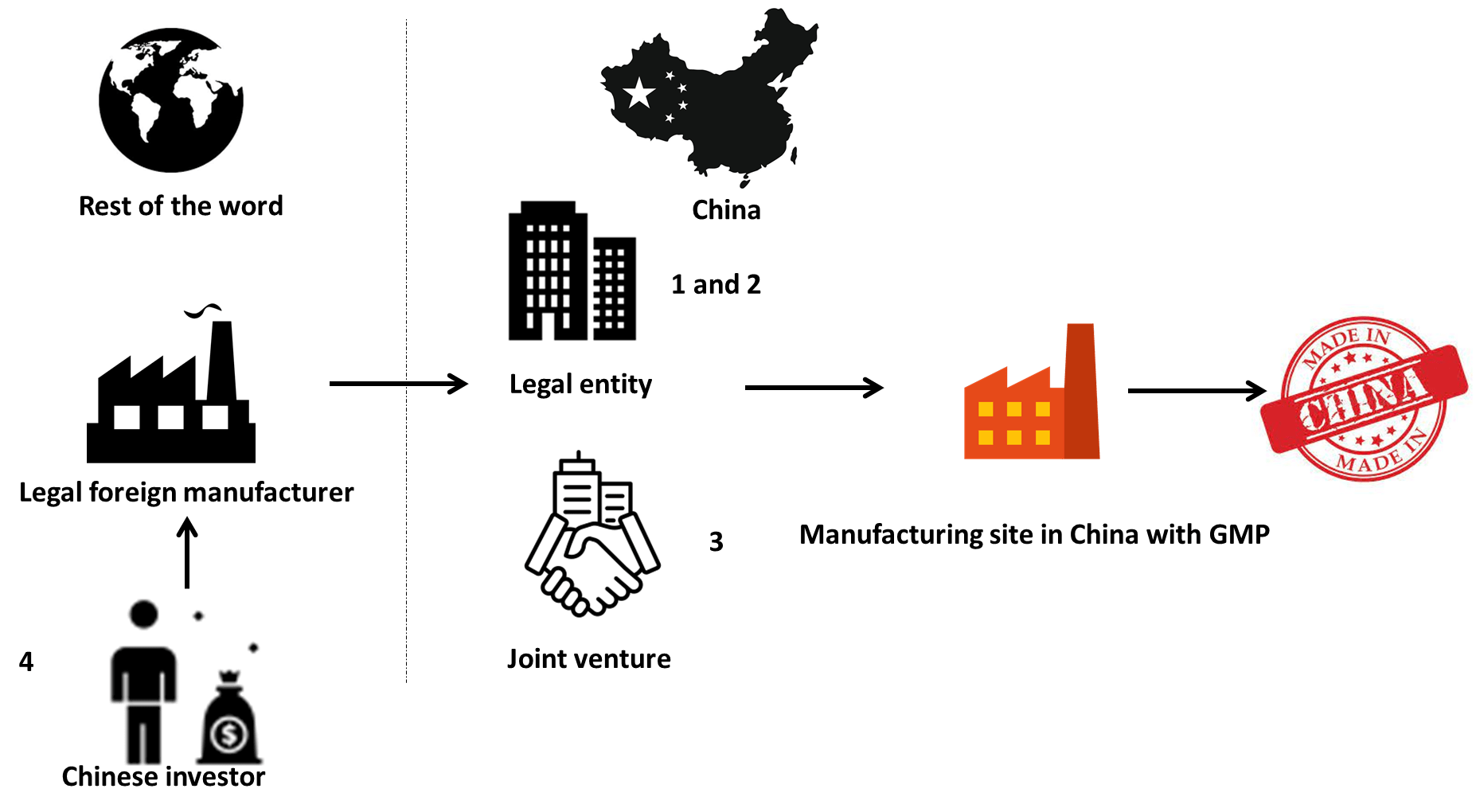
Szenarien zur Herstellung ausländischer Medizinprodukte in China
Von der Gründung einer eigenen juristischen Person bis hin zur chinesischen Fertigung gibt es viele rechtliche Möglichkeiten. Eine allgemeine Analyse liefern wir hier.
1
Eigene juristische Person (F&E) und eigener Produktionsstandort in China
Die typische Niederlassung ausländischer Hersteller in China ist in der Regel ein hundertprozentiges ausländisches Unternehmen, WOFE. Wenn Sie eine unabhängige Rolle bei der Herstellung medizinischer Geräte in China übernehmen möchten, ist dies der längste und sicherste Weg. Sie können Ihr gesamtes geistiges Eigentum in Ihrem eigenen Haus behalten und einen konformen, ähnlichen Produktionsablauf wie bei der Fertigung wünschen:
1. zugelassenes Medizinprodukt und 2. neues Medizinprodukt in China.
2
Eigene juristische Person (F&E) und gekaufter Produktionsstandort in China
Der Aufbau einer Fabrik in China, die den chinesischen GMP entspricht, könnte ein harter Kampf sein. Es dauert länger, qualifiziertes Personal, Ressourcen, Ausrüstung und letztendlich die GMP-Genehmigung durch die Behörde zu finden. Eine weitere Möglichkeit besteht darin, eine bestehende Produktionsstätte mit chinesischem GMP zu erwerben. Diese Produktionseinheit ist also in ausländischem Besitz und erfüllt die Anforderungen der oben genannten Leitlinien. Auch dort besteht weiterhin die Möglichkeit, neue Produkte herzustellen. Ausländische Hersteller sollten eine sorgfältige Prüfung durchführen lassen, um sicherzustellen, dass diese gekaufte Produktionsstätte über einen sehr ähnlichen Produktionsablauf wie die vorherige im Ausland verfügt.
3
Joint Venture und ausgelagerter Fertigungspartner
Wenn Sie einen vertraulichen Partner in China haben, ist die typische Vorgehensweise die Gründung eines Joint Ventures. Sie können in China professionell agieren.
In diesem Fall ist eine Auslagerung der Herstellung zugelassener ausländischer Medizinprodukte zulässig.
4
Finden Sie einen chinesischen Investor
Vielleicht sind Sie ein kleines Unternehmen oder verfügen nur über begrenztes Kapital, um ein chinesisches Unternehmen aufzubauen. Es ist kein Wunder, dass chinesische Investoren großes Interesse daran haben, einzigartige ausländische Produkte mit Spitzentechnologie, jedoch unter eigenem Namen, herzustellen. Es gibt viele legale Möglichkeiten für die Zusammenarbeit mit chinesischen Investoren, entweder im Heimatland legaler Hersteller oder auf dem chinesischen Festland.
Vertrauen Sie unserem zuverlässigen Service
Möchten oder planen Sie, medizinische Geräte in China herzustellen, sei es als typischer legaler Hersteller oder Erstausrüster, Investor oder Interessenvertreter?
Wir möchten mit Ihnen alle Möglichkeiten der Herstellung medizinischer Geräte in China besprechen, von der Gründung einer Niederlassung über die Suche nach einem Produktionsstandort mit chinesischem GMP bis hin zur beschleunigten Genehmigung durch lokale oder zentrale Behörden und der späteren Führung einer chinesischen Ausschreibung.
Vertrauen Sie unserer erstklassigen RA/QM-Expertise und unserer Partnerkanzlei in China.

2. Ausgelagerte Herstellung neuer medizinischer Geräte
Wenn Sie als Erstausrüster (OEM) noch nie auf dem chinesischen Markt tätig sind und die komplette Auftragsfertigung in eine chinesische Fabrik auslagern möchten, können Sie sich für die Vertragsentwicklungs- und Fertigungsorganisation (CDMO) oder die Auftragsfertigung (CM) entscheiden. Der erste CDMO unterscheidet sich nur dadurch, dass Sie gemeinsam mit Ihrem chinesischen Partner entwickeln, während sich der zweite CM nur auf die Produktion von Medizinprodukten konzentriert.
Es gibt viele Szenarien nach der konformen Produktion und Produktzulassung eines neuen in China gekennzeichneten Medizinprodukts. Der OEM kann legaler Hersteller sein oder den Fertigungspartner oder chinesischen Händler als legalen Hersteller weiter auslagern. In diesem Fall verfügt der rechtmäßige Hersteller über die volle Vollmacht für das Medizinprodukt.
Neben legalen Herstellern müssen Sie auch einen chinesischen Vertreter wählen, wenn Sie keine chinesische Tochtergesellschaft haben. Auch hier müssen Sie von Zeit zu Zeit auswählen und ändern, wen Sie möchten: Produktionspartner, chinesischen Händler, einen beliebigen Produktetikettenhersteller (PLM). Der chinesische Vertreter übernimmt die Verbindungsrolle bei allen Post-Market-Aktivitäten zwischen NMPA und dem legalen Hersteller.
Sowohl der gesetzliche Hersteller als auch der chinesische Vertreter sind nach der Produktzulassung obligatorische Inhalte im chinesischen Zertifikat.
Arbeitsablauf der Auftragsfertigung eines neuen Medizinprodukts

Der Vorteil von Option 2 der Auftragsfertigung besteht darin, dass durch die Auftragsfertigung Produktionsbudget gespart und bestehende chinesische GMP genutzt werden kann. Die Herausforderung vor der Produktion besteht darin, dass sowohl ausländische als auch chinesische Standorte die Gerätehistoriendatei während der Forschung und Entwicklung und die Gerätestammdatei während der Produktion verstehen.
Nach der Produktion wird der Auszug aus der Akte des Medizinprodukts, nämlich die technische Dokumentation, auf Chinesisch bei der zuständigen NMPA eingereicht (für MD der Klassen I und II auf Provinzebene), die den typischen Prozess eines in China hergestellten Medizinprodukts durchläuft.




